
| A. | 氯化氢溶于水 | B. | 氧化镁熔化 | ||
| C. | 加热氯酸钾使其分解 | D. | 碘升华 |
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
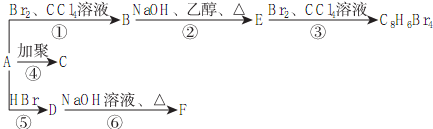
 ,D
,D ,E
,E .
.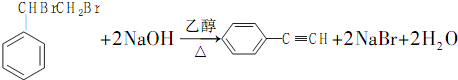 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
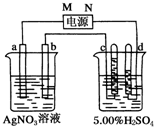 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | Z位于第3周期 IIIA族 | |
| B. | X、Z、W、Q等元素的最高正价等于其所在族的族序数 | |
| C. | Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键 | |
| D. | X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
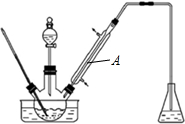
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com