
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | 晶体硅可以制作太阳能电池板 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
分析 A.原煤中加入生石灰可与煤中的硫反应最终生成硫酸钙,起到脱硫的作用;
B.硅为良好的半导体材料;
C.氯气有毒;
D.分散质微粒直径:悬浊液>胶体>溶液.
解答 解:A.原煤中加入生石灰,煤中的硫在煤燃烧时可最终转化生成硫酸钙,达到脱硫的目的,减少污染气体的排放,故A正确;
B.硅为良好的半导体材料,用可于制作太阳能电池板,故B正确;
C.氯气是一种有毒的气体,因氯气与水反应生成的HClO具有强氧化性,所以常用氯气对自来水消毒杀菌故,故C错误;
D.分散质微粒直径:悬浊液>胶体>溶液,故Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D正确;
故选:C.
点评 本题考查了物质的性质和用途,熟悉硅、氯气的性质,熟悉原煤脱硫技术、分散系划分依据是解题关键,题目难度不大,注意对基础知识的积累.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒 容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 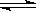 2NH3(g)
2NH3(g) 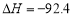 kJ·mol
kJ·mol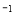 )
)
容器 | 甲 | 乙 | 丙 |
| 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
请写出下列物理量的关系:
(1)浓度c1与c2_________________;2c2与c3________________
(2)能量a与b __________________;2b与c___________________
(3)压强p1与p2_________________;2p2与p3__________________
(4)转化率α1与α2________________;α2与α3___________________
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
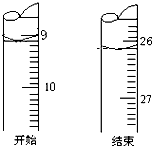 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
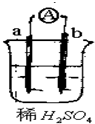
| A. | a发生氧化反应,b发生还原反应 | B. | 碳棒上有气体逸出 | ||
| C. | 导线上有电流,电流方向从a→b | D. | 反应后a极质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
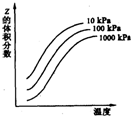 如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | X和Y中只有一种为气态,Z为气态 | B. | X、Y、Z均为气态 | ||
| C. | 上述可逆反应的正反应为放热反应 | D. | 升高温度,上述反应逆向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com