
分析 (1)若经2s 后测得C的浓度为 0.6mol•L-1,生成C为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
平衡 2.8 1.4 1.2
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%计算;
(2)反应速率之比等于化学计量数之比,则反应速率与计量数的比值越大,反应速率越快.
解答 解:(1)若经2s 后测得C的浓度为 0.6mol•L-1,生成C为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
平衡 2.8 1.4 1.2
①物质A表示的反应的平均速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol•(L•s)-1,故错误;
②物质B表示的反应的平均速率为$\frac{\frac{0.6mol}{2L}}{2s}$=0.15mol•(L•s)-1,故正确;
③2s 时物质A的浓度为$\frac{2.8mol}{2L}$=1.4mol•L-1,故正确;
④2s 时物质B的转化率为$\frac{0.6mol}{2mol}$×100%=30%,故错误;
故答案为:C;
(2)反应速率与计量数的比值越大,反应速率越快,$\frac{0.6}{2}$>$\frac{0.15}{1}$,可知A物质表示的反应速率更快,
故答案为:A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率和转化率计算为解答的关键,侧重分析与计算能力的考查,注意比值法比较反应速率的快慢,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就停止了,即正逆反应速率为零 | |
| C. | 在达到平衡的体系中,充入O2,对化学平衡无影响 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应所能达到的限度两个方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
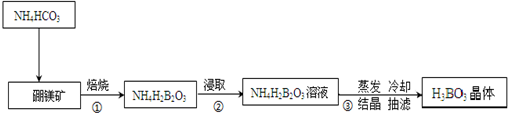
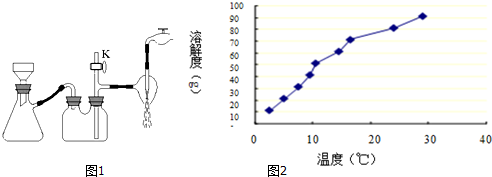
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
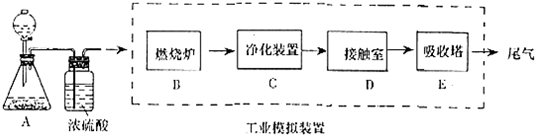

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
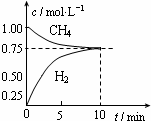 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com