
����Ŀ����֪��4FeO42��+10H2O�T4Fe��OH��3��+8OH��+3O2�������c��FeO42�����ڲ�ͬ�����±仯��ͼ�ס��ҡ���������ʾ��
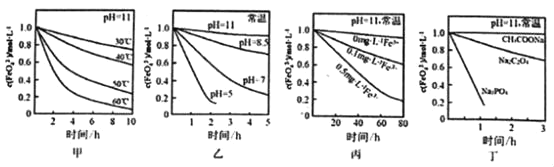
����˵����ȷ���ǣ� ��
A.ͼ�ױ���������������ͬʱ���¶�Խ��FeO42��ת������Խ��
B.ͼ�ұ���������������ͬʱ������ԽǿFeO42��ת������Խ��
C.ͼ������������������ͬʱ������������Fe3+�ܼӿ�FeO42����ת��
D.ͼ������������������ͬʱ�����ζ���FeO42���������ȶ���
���𰸡�C
��������
A���ɼ�ͼ��֪�������¶ȣ�FeO42����Ũ�ȱ仯�ϴ�
B������ͼ��֪����Խǿ��FeO42����Ũ�ȱ仯ԽС��
C���ɱ�ͼ��֪������Ũ��Խ��FeO42����Ũ�ȱ仯Խ��
D���ɶ�ͼ��֪����������Һ�У�FeO42����Ũ�ȱ仯�ϴ�
A���ɼ�ͼ��֪�������¶ȣ�FeO42����Ũ�ȱ仯�ϴ�֪�¶�Խ��FeO42��ת������Խ�죬��A����
B������ͼ��֪����Խǿ��FeO42����Ũ�ȱ仯ԽС�������ԽǿFeO42��ת������ԽС����B����
C���ɱ�ͼ��֪������Ũ��Խ��FeO42����Ũ�ȱ仯Խ��C��ȷ��
D���ɶ�ͼ��֪����������Һ�У�FeO42����Ũ�ȱ仯�ϴ�֪���β�����FeO42���������ȶ��������д�����Ϊ�������ȶ�������D����
��ѡ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L 2 mol��L��1ϡ������Һ���������ۣ���Ӧ��������������ʵ�����������۵����ʵ����Ĺ�ϵ��ͼ��ʾ��
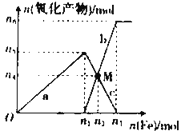
�ش��������⣺
(1)������a��Ӧ�����ӷ���ʽΪ_____��
(2)����b��������Ϊ_____________��n2��ֵΪ__________��
(3)��M��ʱ�ټ���V L 2 mol��L��1��ϡ���ᣬǡ�÷�Ӧ��ȫ����VΪ_____________��
(4)�о����������Ũ��ԽС����Ӧ�Ļ��ϼ�Խ�͡��ڼ�ϡ��������Һ�м����������ۣ�����NH4�������ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ�ϳ��Ǽ��㶹���м���Ľṹ��ʽ������˵����ȷ���ǣ� ��
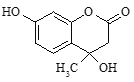
A.�����ʷ���������̼ԭ�ӿ��ܹ�ƽ��
B.����������Cu�������������������ɺ�ȩ��������
C.1mol�÷���������3molNaOH��Ӧ
D.��������ˮ��Ӧ��1mol�÷����������1molBr2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.![]() Cl��ʾ������Ϊ18����Ԫ�ص�һ�ֺ���
Cl��ʾ������Ϊ18����Ԫ�ص�һ�ֺ���
B.����������CH3COOCH2CH3����Ӳ֬���������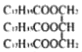 ����Ϊͬϵ��
����Ϊͬϵ��
C.![]() ������Ϊ2���һ�����
������Ϊ2���һ�����
D.CH3��CH2��2CH3��CH��CH3��3��Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���J���ҹ������ɹ��з���һ����ҩ���ϳ�J��һ��·����ͼ��
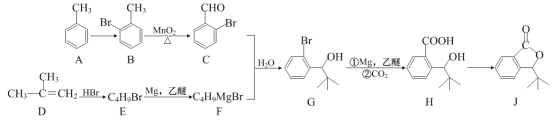
��1����A����B�ķ�Ӧ������Լ�����Ӧ����Ϊ___��
��2����B����C�ķ�Ӧ����Ϊ___��
��3��D___����д����������������������˳���칹����
��4��C������������ͭ��Ӧ�Ļ�ѧ����ʽΪ___(�������±����ϵ��岻���뷴Ӧ)��
��5��д��ͬʱ��������������J��һ��ͬ���칹��Ľṹ��ʽ___��
�ٷ����г������ⲻ��������״�ṹ��
���ܷ���������Ӧ��
�۷�����ֻ������2�ֲ�ͬ��ѧ�������⡣
��6��д�����Ҵ�������Ϊԭ���Ʊ�![]() �ĺϳ�·��ͼ___�����Լ����������ã��ϳ�·��ͼʾ����������ɣ���
�ĺϳ�·��ͼ___�����Լ����������ã��ϳ�·��ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I������ʯ��������Ṥҵ��β������NO��NO2����Ӧ�����ܾ���β�������ܻ��Ӧ�ù㷺��Ca(NO2)2���䲿�ֹ����������£�

��1��һ�������£�NO��NO2�������з�Ӧ��NO(g) + NO2(g) ![]() N2O3(g)����ƽ�ⳣ������ʽΪK = ____��
N2O3(g)����ƽ�ⳣ������ʽΪK = ____��
��2������ʱ��β�������������룬ʯ����������������ܣ��ô���____��
��3��Ϊ���Ca(NO2)2�IJ��ʼ����ȣ���n(NO)��n(NO2)Ӧ����Ϊ____��
��4����������Һ�豣�������ԣ���������Һ��Ca(NO2)2�ᷢ���ֽ⣬����֮һ��NO���䷴Ӧ�����ӷ���ʽΪ___��
II�����ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ������������е�Ӧ�������㷺��
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ�����������Ʊ�����������ص��Ȼ�ѧ����ʽ���£�
Al2O3(s) + AlCl3(g) + 3C(s) =3AlCl(g) + 3CO(g) ��H = a kJ��mol��1
3AlCl (g)=2Al(l) + AlCl3(g) ��H = bkJ��mol��1
��Al2O3(s) + 3C(s) =2Al(l) + 3CO(g) ��H = __kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ����
��2�������������Խ��Al��AgO��ؿ�����ˮ�¶�����Դ����ԭ����ͼ��ʾ���õ�ط�Ӧ�Ļ�ѧ����ʽΪ____��
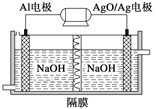
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(15 ��)������H �Ǻϳ�ҩ������ɳ����������Ҫ�м��壬��ϳ�·�����£�
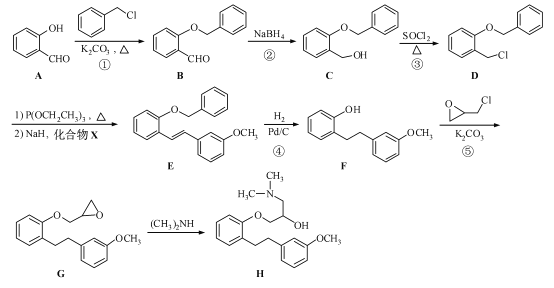
(1)������A �еĺ���������Ϊ �� (�����������)��
(2)��Ӧ�١����У�����ȡ����Ӧ���� (�����)��
(3)д��ͬʱ��������������B ��һ��ͬ���칹��Ľṹ��ʽ�� ��
I. �����к�������������II. ��������7 �ֲ�ͬ��ѧ�������⣻III. ������FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ�ܷ����˷�Ӧ��
(4)ʵ��D��E ��ת���У�����Ļ�����X �ܷ���������Ӧ��X �Ľṹ��ʽΪ ��
(5)��֪��![]() ��������
��������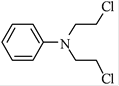 �Ǻϳɿ���ҩ���������м��壬��д����
�Ǻϳɿ���ҩ���������м��壬��д����![]() ��
��![]() Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ 8NH3��6NO2  12H2O��7N2���ѳ������е� NO2�������йظ÷�Ӧ��˵������ȷ����
12H2O��7N2���ѳ������е� NO2�������йظ÷�Ӧ��˵������ȷ����
A.NH3 ��������
B.NO2 ����������Ӧ
C.NO2�ڷ�Ӧ�еõ�����
D.ÿ���� 0.7mol N2����Ӧת�� 2.4��6.02��1023������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������20���µ�Ksp���£�
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10��10 | 5.4��10��13 | 8.3��10��17 | 2.0��10��48 | 2.0��10��12 |
����˵������ȷ����
A. 20��ʱ�������������α�����Һ�У�Ag�����ʵ���Ũ���ɴ�С��˳����:Ag2CrO4��AgCl��AgBr��AgI��Ag2S��
B. ��BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��c(Br -) /(Cl -)��2.7��10��3
C. �ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����K2CrO4
D. ij��Һ�к���Cl����Br����I����Ũ�Ⱦ�Ϊ0.010 mol��L-1�������Һ����μ���0.010 mol��L-1��AgNO3��Һʱ��Cl�����ȳ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com