
| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: | ||
| C. | 丙烷分子的球棍模型示意图: | D. | -CH3(甲基)的电子式为: |
分析 A.最简式为其各元素原子的最简比;
B.甲苯中不含有官能团;
C.丙烷分子中含有2个甲基、1个亚甲基,碳原子半径大于H,据此判断其球棍模型;
D.甲基中碳原子最外层为7个电子,漏掉了碳原子的一个电子.
解答 解:A.乙炔的分子式为C2H2,则其最简式为CH,故A错误;
B.甲基苯为甲基取代了苯环上的1个H原子形成的,其分子中不存在官能团,故B错误;
C.丙烷分子中含有2个甲基和1个亚甲基,其球棍模型示意图为: ,故C正确;
,故C正确;
D.甲基中碳原子最外层为7个电子,甲基的电子式为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,注意掌握最简式、电子式、球棍模型与比例模型等化学用语的概念及表示方法,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
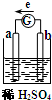 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定只含离子键 | |
| B. | 共价化合物中一定只含共价键 | |
| C. | 离子化合物中不一定含有金属元素 | |
| D. | 共价键不一定只存在于共价化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH$→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳2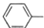 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
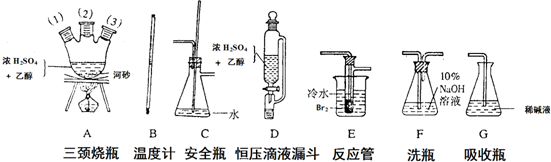
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com