
【题目】下列说法正确的是( )
A.利用键长及键能的数据可判断:稳定性![]()
B.金属的电子气理论,可以解释金属易导电易腐蚀的原因
C.化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因
D.活化能越大就代表化学反应需要吸收或放出的能量就越大
【答案】C
【解析】
A.非金属性:C>Si;元素的非金属性越强,其对应的简单氢化物的稳定性就越强,故CH4与SiH4的稳定性:CH4>SiH4,选项A错误;
B.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电,能用金属晶体结构加以解释,金属易腐蚀与金属晶体结构无关、与化学性质有关,金属的化学性质比较活泼,容易被空气中的氧气所氧化,故金属易腐蚀不能用金属晶体结构加以解释,选项B错误;
C.化学键的断裂要吸收能量,化学键的形成要放出能量,所以化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因,选项C正确;
D.反应的活化能越大,反需要的能量越多,但反应前后的能量变化不一定越大,即反应热的数值不一定大,选项D错误。
答案选C。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液W由下列离子中的若干种组成:H+、![]() 、Fe3+、Ba2+、Mg2+、
、Fe3+、Ba2+、Mg2+、![]() 、I-、OH-、
、I-、OH-、![]() 。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
A.X一定是Al3+B.Y一定是H2
C.W中最多含有6种离子D.溶液中不可能含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A.a点是CaSO4的饱和溶液而b点不是
B.蒸发水可使溶液由b点变化到a点
C.常温下,CaCO3(s)+![]() (aq)
(aq)![]() CaSO4(s)+
CaSO4(s)+![]() (aq)的K=3.1×10-4
(aq)的K=3.1×10-4
D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是
CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是

A. 平衡常数K(300 ℃)<K(500 ℃)
B. 在其他条件不变时,压缩处于E点的体系体积,氢气浓度增大
C. 300 ℃,当容器内气体密度不变时说明反应已经达到平衡
D. 500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)=![]() mol·L1·min1
mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡的判断正确的是( )
A.化学平衡向正反应方向移动,反应物的转化率不一定增大
B.对于放热反应,降低温度将缩短反应达到平衡的时间
C.对于有气体参加的反应,改变反应体系的压强,化学平衡一定移动
D.同一可逆反应,在温度![]() 时,反应对应的平衡常数
时,反应对应的平衡常数![]() ,则说明该反应为放热反应
,则说明该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素形成的单质和化合物在化工、材料、医学等领域应用广泛,回答下列问题:
(1)区分金刚石和无定形碳最可靠的科学方法为___________。基态C原子核外未成对电子的数目为_____________。
(2)咖啡因结构为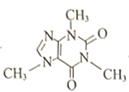 。
。
①咖啡因中C原子的杂化形式为_________________。
②1 mol咖啡因中所含![]() 键数目为_________________。
键数目为_________________。
③咖啡因通常在水中的溶解度较小,加入适量![]() 能增大其在水中溶解度的原因为_________________。
能增大其在水中溶解度的原因为_________________。
④CH3+(甲基正离子)的立体构型为_________________。
(3)CO、NO、H2S均为生命体系气体信号分子。其中H、C、O、S的电负性由大到小的顺序为____________;N、O、S的第一电离能由大到小的顺序为________________。
(4)干冰可用于人工降雨。其熔点低于金刚石的原因为___________;若干冰的密度为1.56 g/cm3,立方晶胞参数为0.57 nm,则每个晶胞实际占用CO2的数目为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com