
| A. | 防止炭化结焦 | B. | 提高汽油的产量和质量 | ||
| C. | 可得到更多的柴油 | D. | 可得到更多的煤油 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
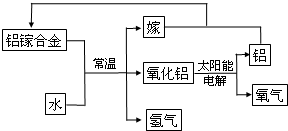 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.
现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液 (Na2CO3) 加入适量的稀硫酸 | |
| B. | CO2(HCl) 先通过足量的NaOH溶液,再通过浓硫酸干燥 | |
| C. | Cu(CuO) 先加过量的稀硫酸,再过滤 | |
| D. | NaOH溶液(Na2CO3) 加过量的Ba(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com