
空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
科目:高中化学 来源: 题型:
可用于鉴别以下三种化合物的一组试剂是
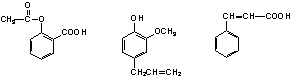
乙酰水杨酸 丁香酚 肉桂酸
①溴的四氯化碳溶液 ②银氨溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与④ B.①与③ C.③与④ D.①与②
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲醇是一种优质燃料,可制作燃料电池。
①工业上可用下列两种反应制备甲醇:
 CO(g) + 2H2(g)
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g)+3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3
则2CO(g)+O2(g) =2CO2(g) 的反应热ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
②生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”);
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)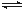 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
计算反应上述反应的焓变△H=_____________。
(3)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol
请回答下列问题:
①生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“大于”、“小于”或“等于”)
(4)已知:
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=—890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=—566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的________倍(计算结果保留1位小数)。
(5)已知热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g);△H=+765.2 kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H=+765.2 kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于鉴别以下三种化合物的一组试剂是

乙酰水杨酸 丁香酚 肉桂酸
①溴的四氯化碳溶液 ②银氨溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与④ B.①与③ C.③与④ D.①与②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,错误的是
A. 氯气通入硝酸银溶液中:Cl2+H2O+Ag+→AgCl↓+H++HClO
B. 用硫酸铜溶液吸收硫化氢气体:Cu2+ + S2- → CuS↓
C. 次氯酸钠溶液中通入少量二氧化碳 ClO-+ H2O + CO2 → HCO3-+ HClO
D. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-→ BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)今有2H2+O2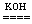 2H2O反应,构成燃料电池,则电极反应式为:负极____________________、正极__________________。
2H2O反应,构成燃料电池,则电极反应式为:负极____________________、正极__________________。
(2)如把H2改为甲烷,KOH做导电物质,则负极电极反应式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a>b>c
B.同pH时,三种溶液稀释相同倍数后的pH:a<b<c
C.同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D.同pH时,稀释不同倍数后pH仍相同,三种溶液稀释的倍数:a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com