
| A. | 2-氯丙烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 1-丁烯 |
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO42-、NO3- | B. | Al3+、Na+、HCO-3、Cl- | ||
| C. | Fe3+、K+、Cl-、SCN- | D. | K+、SO2-4,Na+、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
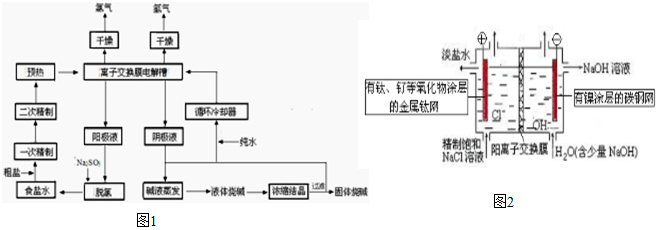
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
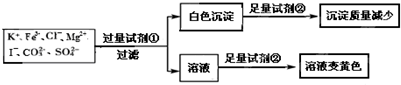
| A. | 试剂①为硝酸钡 | |
| B. | 试剂②一定为盐酸 | |
| C. | 该溶液中一定有 I-、CO32-、SO42-、K+ | |
| D. | 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
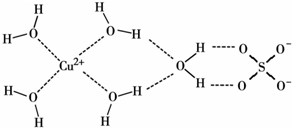
 .
.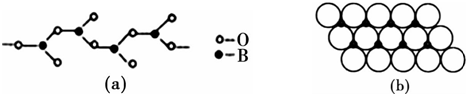
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com