
| A. | 平行光照射胶体产生丁达尔现象 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 电解质溶液导电过程 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
科目:高中化学 来源: 题型:解答题
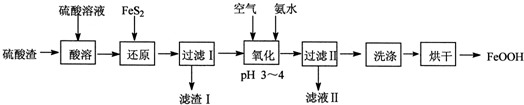
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
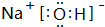 、
、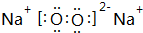 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中KC1O3的最大理论产量为1/7amol | |
| C. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$ | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、锥形瓶、试管、温度计 | 探究温度对H2SO4和Na2S2O3反应速率的影响 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、电子天平 | 用固体氯化钠配制100mL0.5mol•L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
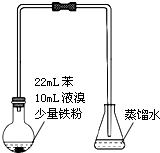 溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.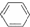 +Br2$\stackrel{铁屑}{→}$
+Br2$\stackrel{铁屑}{→}$ +HBr
+HBr| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ag+、NO3-、SO42- | B. | Fe3+、Cu2+、SO32-、ClO- | ||
| C. | Na+、K+、AlO2-、OH- | D. | Ca2+、H+、C6H5O-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com