
| A、E是一种非金属元素 |
| B、在ECln中E与Cl之间形成共价键 |
| C、E的一种常见氧化物为EO |
| D、E位于元素周期表的ⅥA族 |
| 57.4g |
| 143.5g/mol |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
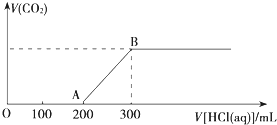 向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a电极上有气体放出,b电极上无气泡,溶液pH变大 |
| B、a是正极,b是负极 |
| C、导线中有电子流动,外电路中,电子从a极到b极 |
| D、a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、0.5NA个氯分子所占体积约为11.2L |
| C、28g氮气所含原子数为2NA |
| D、18g水所含的质子总数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为:Pb+SO42--2e-═PbSO4 |
| B、负极反应为:PbO2+SO42-+4H++2e-═PbSO4+2H2O |
| C、随着电池的工作,电解质溶液中H2SO4的浓度逐渐降低 |
| D、随着电池的工作,负极区的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I2>Cl2>Fe3+>MnO4- |
| B、MnO4->Cl2>Fe3+>I2 |
| C、Cl2>I2>Fe3+>MnO4- |
| D、Fe3+>MnO4->Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液中混有Ba(OH)2(K2SO4) |
| B、NaCl溶液中混有Na2CO3(盐酸) |
| C、CO中混有CO2(炽热的炭) |
| D、CO2中混有HCl气体(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )
甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )| A、在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>(H+)>c(OH-) |
| D、在D点:c(HCOO-)+c(HCOOH)=2c(K+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com