
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现

 ①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.据反应条件无法判断反应是否吸热
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成原理:CO(NH2)2+H2O2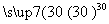 CO(NH2)2·H2O2。
CO(NH2)2·H2O2。
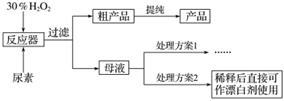
请回答下列问题:
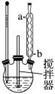
(1)流程图中反应器的装置如图所示,推测该反应的加热方式是______________________;回流管中冷水流从____________口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是__________________________。
(2)母液处理方案1可以是______________(用文字表达)。若欲从母液中分离出H2O2和尿素,可采用的操作是______(选填序号)。
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品2.000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L-1的硫酸,然后用0.100 0 mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00 mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式:______MnO +______H2O2+________________________
+______H2O2+________________________
H+===______Mn2++______H2O+______。
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量________。(填“偏高”、“偏低”或“不变”)
③根据滴定结果,可确定产品中活性氧的质量分数为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:
2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1) 在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)。
(2) 前2s内的平均反应速度v(N2)= 。
(3) 假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/ ℃ | NO初始浓度/ mol·L-1 | CO初始浓度/ mol·L-1 | 催化剂的比表面积/ m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①请在空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的II、III两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。


查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒沙特列原理来解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深。
C.将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应
D.用过量空气煅烧硫铁矿可以提高硫铁矿的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.草酸能使酸性高锰酸钾溶液褪色
B. MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.用稀硫酸和Zn反应制H2时,加少量CuSO4溶液对反应速率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中发生反应H2(g)+I2(g) 2HI(g),下列方法能说明反应已经达到平衡状态的是( )
2HI(g),下列方法能说明反应已经达到平衡状态的是( )
A.容器内每减少1mol I2,同时生成2mol HI B.容器内气体压强不再变化
C.混合气体的颜色不再变化 D.混合气体的密度恒定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) =N2(g)+2C02(g) ∆H=-746.4 kJ·mo I -1。起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为lmol。下列有关反应速率的说法中,正确的是
A.反应前5秒钟内,用NO表示的平均反应速率为0.l·mo I(L·s)-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有: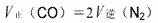
D.保持容器体积不变,往容器中充入lmol 02,正逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com