
分析 根据混合物、电解质、非电解质、非金属单质、碱类物质的定义判断;根据物质导电的原因判断.
混合物:含有的物质有多种;
能导电的物质必须有自由电子或离子;
非电解质:在水溶液里或熔融状态下都不导电的化合物;
碱:在水溶液里,电离出的阴离子全部是氢氧根离子的化合物.
解答 解:A蔗糖(C12H22O11)不能导电,属于化合物,是非电解质;
B碘的酒精溶液不能导电,属于混合物,既不是电解质也不是非电解质;
C纯碱不能导电,溶于水或熔融状态下能导电,属于电解质;
D烧碱不能导电,溶于水或熔融状态下能导电,属于电解质;
E二氧化碳不能导电,其溶于水能导电的原因是生成了碳酸,碳酸导电,属于非电解质;
F石墨能导电,是非金属单质,既不是电解质也不是非电解质;
G硫酸铝溶液能导电,属于混合物,既不是电解质也不是非电解质;故答案为:①BG; ②D; ③CD; ④FG.
点评 本题考查了混合物与纯净物、电解质与非电解质的区别,侧重考查学生的辨别能力;知道:能导电的物质不一定是电解质,如金属单质;电解质不一定导电,如氯化钠晶体.


科目:高中化学 来源: 题型:解答题

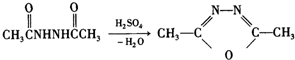
 +H2N-NH2→
+H2N-NH2→ ,
, ,
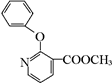
,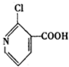 有多种同分异构体,其中符合下列条件的同分异构体共有4种.
有多种同分异构体,其中符合下列条件的同分异构体共有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生了颜色变化的一定是化学变化 | |
| B. | 有气泡产生或固体析出的变化一定是化学变化 | |
| C. | 用糯米、酒曲和水制成甜酒酿一定是化学变化 | |
| D. | 氧化还原反应中肯定有一种元素被氧化,而另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
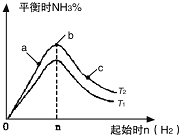 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③⑥⑤⑥ | B. | ②⑥③⑥⑤⑥ | C. | ①⑥④⑥⑤⑥ | D. | ②⑥④⑥⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com