
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
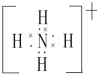 (用元素符号表示).
(用元素符号表示). ,
,分析 X的原子最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,最外层是L层,L层上电子数是4,则R原子核外电子数=2+4=6,所以该元素是C元素;
Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;
T元素原子的最外层电子数是电子层数2倍的元素,由原子序数关系可知T为S元素;
Z的最高正价为+7价,应为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:X的原子最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,最外层是L层,L层上电子数是4,则R原子核外电子数=2+4=6,所以该元素是C元素;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;T元素原子的最外层电子数是电子层数2倍的元素,由原子序数关系可知T为S元素;Z的最高正价为+7价,应为Cl元素,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径S>Cl>C>N,故答案为:S>Cl>C>N;
(2)YH4+为铵根离子,电子式为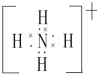 ,故答案为:
,故答案为: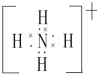 ;
;
(3)硫离子核外有3个电子层,最外层电子数为8,结构示意图为 ,故答案为:
,故答案为: ;
;
(4)非金属的非金属性越强,其简单阴离子的还原性越弱,其单质的氧化性越强,硫离子能还原氯气生成氯离子,所以硫离子还原性大于氯离子,离子方程式为Cl2+S2-=S+2Cl-,故答案为:Cl2+S2-=S+2Cl-;
(5)氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)n(C)=$\frac{9g}{12g/mol}$=0.75mol,n(NaOH)=1L×1mol•L-1=1mol,二者发生3CO2+4NaOH=Na2CO3+2NaHCO3+2H2O,由方程式可知生成0.25molNa2CO3、0.5molNaHCO3,质量为0.25mol×106g/mol+0.5mol×84g/mol=68.5g.
故答案为:68.5.
点评 本题考查结构性质位置关系应用,为高频考点和常见题型,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握,难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:1720Cl | B. | S2-的结构示意图: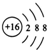 | ||
| C. | 四氯化碳的电子式: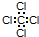 | D. | 乙醇的结构式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题:
A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
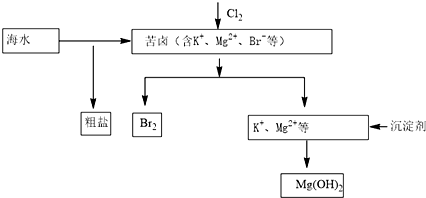
| A. | 工业生产中常选用NaOH作为沉淀剂 | |
| B. | 粗盐可采用溶解、过滤和重结晶等过程进一步提纯 | |
| C. | 向苦卤中通入Cl2是为了提取溴 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH=4的醋酸稀释成PH=6的溶液 | 加H2O的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com