



 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
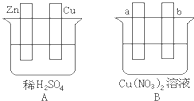 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省执信中学高二上学期期末考试理科化学试卷(带解析) 题型:填空题
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。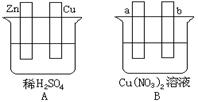
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。

(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com