
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
分析 用石墨电极电解下列溶液,则阳离子在阴极放电,阴离子在阳极放电,若加入物质能使溶液恢复到原来的成分和浓度,则从溶液中析出什么物质就应加入什么物质,以此来解答.
解答 解:A.电解AgNO3溶液,银离子和氢氧根离子放电,应加入氧化银恢复原样,故A错误;
B.电解NaOH溶液,氢离子和氢氧根离子放电,则加入水能恢复原样,故B错误;
C.电解KCl溶液,氢离子和氯离子放电,则应加入HCl恢复原样,故C错误;
D.电解CuSO4溶液,铜离子和氢氧根离子放电,则一段时间内应加入氧化铜能恢复原样,故D正确.
故选D.
点评 本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,明确惰性电极电解溶液时离子的放电顺序是解答本题的关键,并结合信息来解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的产物能发生银镜反应 | |
| C. | 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) | |
| D. | A在一定条件下发生缩聚反应的产物是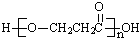 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
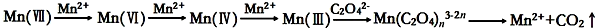
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
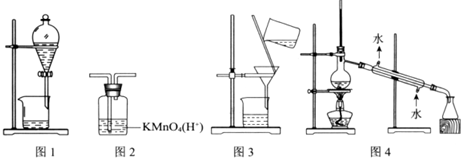
| A. | 图1 分离乙醇和乙酸 | B. | 图2 除去乙炔中的乙烯 | ||
| C. | 图3 除去溴苯中的溴单质 | D. | 图4 除去工业酒精中的甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com