
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
(1)过滤(1分)
(2)2FeCl3 +Fe = 3FeCl2(2分); 2FeCl3 + Cu= 2FeCl2 +CuCl2(2分)
(3)Cu粉(2分)
(4)① MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O(2分) ② 0.4XY(2分)
(5)Fe3+>Cu2+>Mn2+(2分)
(6)22.4Z/64 (2分); 4OH- ―4e-=O2↑ + 4H2O(2分)
解析试题分析:根据题给流程图和信息知,废旧合金(含有Cu、Fe、Si 三种成分)与过量FeCl3溶液混合发生的反应为2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2,过滤,固体A的成分为Si,溶液a的成分为FeCl3 、FeCl2 和CuCl2的混合液;电解含Cu2+、Cl—、K+的溶液的固体B,B的成分为Cu;溶液a加过量还原剂反应后过滤得固体B(Cu),则还原剂为铜,发生的反应为2FeCl3 + Cu= 2FeCl2 +CuCl2,溶液b的成分为FeCl2 和CuCl2的混合液;溶液b中加入酸性高锰酸钾溶液,亚铁离子被氧化为铁离子,用氢氧化钾溶液调节溶液的PH,铁离子转化为氢氧化铁沉淀,灼烧的氧化铁,溶液d经处理的金属锰。(1)由流程图知,操作Ⅰ、Ⅱ、Ⅲ为分离固液混合物的操作,指的是过滤;(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2;(3)由上述分析知,过量的还原剂应是Cu粉;(4)①向溶液b中加入酸性KMnO4溶液亚铁离子被氧化为铁离子,反应的离子方程式为MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O;②根据相关反应的关系式:2MnO4-—— 10Fe2+——5Fe2O3,用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为0.4XYg;(5)根据题意知,溶液c中所含的金属阳离子为Fe3+、Cu2+和Mn2+,若三者浓度相等,向溶液c中逐滴加入KOH溶液,根据题给溶度积产生判断,Fe3+所需氢氧根浓度最小先沉淀,Mn2+所需氢氧根浓度最大,最后沉淀,则三种金属阳离子沉淀的先后顺序为:Fe3+>Cu2+>Mn2+;(6)根据题意知,电解过程的电极反应式依次为:阳极:4OH- ―4e-=O2↑ + 4H2O;阴极:Cu2+ + 2e-= Cu;2H+ + 2e- = H2↑;根据电子守恒计算,标况下阳极生成的最后一种气体体积为22.4Z/64L。
考点:以化学工艺流程为载体考查化学实验基本操作、反应方程式的书写、沉淀溶解平衡及电解计算。


科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA-,HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因
__________________________________________________
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能
______(填“>”、“<”或“=”)0.11 mol·L-1;理由是____________________________
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。
| A.c(Na+)>2c(CO32—) |
| B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3) |
| C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3) |
| D.c(CO32—)+c(HCO3—)="0.1" mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90 ℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液:________;NH4Cl溶液:________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),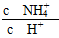 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 | HA的物质的 量浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com