
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐![]() (用
(用![]() 代表)。回答下列问题:
代表)。回答下列问题:
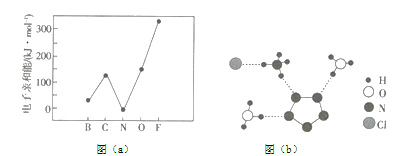
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(![]() )。第二周期部分元素的
)。第二周期部分元素的![]() 变化趋势如图(a)所示,其中除氮元素外,其他元素的
变化趋势如图(a)所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是__________;氮元素的
自左而右依次增大的原因是__________;氮元素的![]() 呈现异常的原因是_________。
呈现异常的原因是_________。
(2)经![]() 射线衍射测得化合物
射线衍射测得化合物![]() 的晶体结构,其局部结构如图(b)所示。
的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,![]() 中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
A 中心原子的杂化轨道类型 B 中心原子的价层电子对数
C 立体结构 D 共价键类型
②![]() 中阴离子
中阴离子![]() 中的键总数为__________个。分子中的大
中的键总数为__________个。分子中的大![]() 键可用符号表示
键可用符号表示![]() ,其中
,其中![]() 代表参与形成大
代表参与形成大![]() 键的原子数,
键的原子数,![]() 代表参与形成大
代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )则
)则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
③图(b)中虚线代表氢键,其表示式为![]() 、__________、__________。
、__________、__________。
【答案】同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 ![]() 原子的
原子的![]() 轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5
轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5 ![]()
![]() )
) ![]() )
)
【解析】
(1)从图(a)可以看出:除![]() 外,同周期元素随核电荷数依次增大,
外,同周期元素随核电荷数依次增大,![]() 逐渐增大,这是因为随原子半径逐渐减小,结合一个电子需要释放出更多的能量;
逐渐增大,这是因为随原子半径逐渐减小,结合一个电子需要释放出更多的能量;![]() 原子的
原子的![]() 轨道处于半充满状态,不易再结合一个电子,所以
轨道处于半充满状态,不易再结合一个电子,所以![]() 呈现异常,故答案为:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
呈现异常,故答案为:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;![]() 原子的
原子的![]() 轨道为半充满状态,具有额外稳定性,故不易结合一个电;
轨道为半充满状态,具有额外稳定性,故不易结合一个电;
(2)①结合图(b)可知:晶体![]() 中两种阳离子为
中两种阳离子为![]() 和
和![]() ,两种阳离子的中心原子均采取
,两种阳离子的中心原子均采取![]() 杂化;
杂化;![]() 中成键电子对数为4,
中成键电子对数为4,![]() 中含1个孤电子对和3个成键电子对,即中心原子的价层电子对数均为4;两种阳离子中均存在极性键,不存在非极性键;
中含1个孤电子对和3个成键电子对,即中心原子的价层电子对数均为4;两种阳离子中均存在极性键,不存在非极性键;![]() 和
和![]() 分别为正四面体结构和三角锥形结构,即立体结构不同,故答案为:ABD;C;
分别为正四面体结构和三角锥形结构,即立体结构不同,故答案为:ABD;C;
②从图(b)可以看出:阴离子![]() 呈五元环状结构,其含有的
呈五元环状结构,其含有的![]() 键总数为5个;
键总数为5个;![]() 中参与形成大
中参与形成大![]() 键的电子数为6所以可将其中的大
键的电子数为6所以可将其中的大![]() 键表示为
键表示为![]() ,故答案为:5;
,故答案为:5;![]() ;
;
③从图(b)可以看出,铵根中氢原子与氯原子之间存在氢键,表示为![]() ,水合氢离子中的氢原子和
,水合氢离子中的氢原子和![]() 中的氮原子存在氢键,表示为
中的氮原子存在氢键,表示为![]() ),铵根中的氢原子和
),铵根中的氢原子和![]() 中的氮原子存在氢键,表示为
中的氮原子存在氢键,表示为![]() ),故答案为:
),故答案为:![]() );
);![]() )。
)。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是 W 的单质,q 是 Y 的单质,s 是 Z 的单质且常温下为淡黄色固体,m 与 r 相遇会产生白烟。上述物质的转化关系如图所示。下列说法不正确的是( )
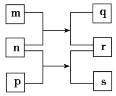
A.原子半径:Z>W>X
B.Y 的一种氢化物可作为火箭的燃料
C.Z 的氧化物对应的水化物酸性一定比 W 的弱
D.X、Y、W 三种元素组成的化合物可为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:

下列说法中不正确的是( )
A. 乙苯的一氯代物共有3种不同结构
B. 苯乙烯和氢气生成乙苯的反应属于加成反应
C. 苯乙烯分子中所有原子有可能位于同一平面上
D. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①_______,⑥_______,⑦_______,_________。
(2)在这些元素形成的单质中,最活泼的金属单质是_____________,最活泼的非金属单质是_________(用化学符号做答)。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,碱性最强的是____________,呈两性的是___________,以上三者之间相互反应的化学方程式:________________________;________________________;________________________
(4)在④与⑤形成的单质中,化学性质较活泼的是____________(填名称),设计两个原理不同的简单实验。
方案一:________________________________________________;
方案二:________________________________________________。
(5)在⑦与⑧形成的单质中,化学性质较活泼的是____________,写出可以证明该结论的一个离子反应方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明HNO2是弱电解质的是( )
①滴入酚酞,NaNO2溶液显红色②用HNO2溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
④0.1molL-1HNO2溶液的pH=2⑤HNO2与CaCO3反应放出CO2气体
⑥c(H+)=0.1molL-1的HNO3溶液稀释至1000倍,pH<4
A.②⑤B.①⑤C.③⑥D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(![]() )在
)在![]() 催化下能将烟气中的
催化下能将烟气中的![]() 、
、![]() 分别氧化为
分别氧化为![]() 和
和![]() ,
,![]() ,也可在其他条件下被还原为
,也可在其他条件下被还原为![]() 。
。
(1)![]() 中心原子轨道的杂化类型为__________;
中心原子轨道的杂化类型为__________;![]() 的空间构型为__________(用文字描述)。
的空间构型为__________(用文字描述)。
(2)与![]() 分子互为等电子体的一种阴离子为__________(填化学式)。
分子互为等电子体的一种阴离子为__________(填化学式)。
(3)![]() 分子中
分子中![]() 键与
键与![]() 键的数目比
键的数目比![]() __________。
__________。
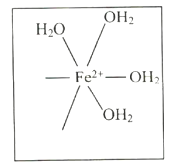
(4)![]() 与
与![]() 反应生成的
反应生成的![]() 中,
中,![]() 以
以![]() 原子与
原子与![]() 形成配位键。请在
形成配位键。请在![]() 结构示意图的相应位置补填缺少的配体_________。
结构示意图的相应位置补填缺少的配体_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如图所示:
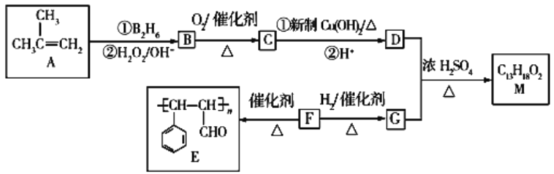
已知:R—CH=CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)有机物B的系统命名为___。
(2)F中所含官能团的名称为___,F→G的反应类型为___。
(3)M的结构简式为___。
(4)B→C反应的化学方程式为___。
(5)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体,满足与FeCl3溶液反应显紫色的有___种。其中核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1∶1∶2∶6的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A. 溶液中水电离出的c(H+)=10-10 mol/L
B. 溶液中c(H+)+c(A-)=0.1 mol/L
C. 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D. 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com