
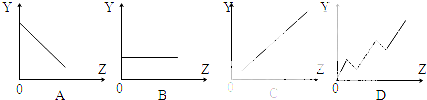
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| 元素代号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
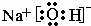 ,故答案为:
,故答案为: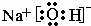 ;
;

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
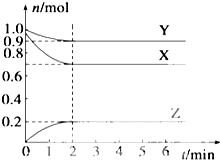 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
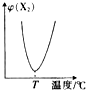 两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )
两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )| A、放热反应 |
| B、吸热反应 |
| C、可能是放热反应,也可能是吸热反应 |
| D、无法判断反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、举行“地球一小时”熄灯活动 |
| B、露天焚烧稻草和秸秆 |
| C、夏天将空调的温度设置在26℃以上 |
| D、生活垃圾分类回收处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1=c2 |
| B、c1=3 c2 |
| C、c2=3 c1 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体NaCl不导电,但NaCl是电解质 |
| B、Cu能导电,所以Cu是电解质 |
| C、NH3溶于水能导电,所以NH3是电解质 |
| D、BaSO4的水溶液不导电,所以BaSO4是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com