

| 温度T(K) | 273K | 323K | 373K |
| 平衡常数 | 0.005 | 0.022 | 0.36 |
| c2(B) |
| c(A) |
| c2(B) |
| c(A) |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
| A、60mL | B、240mL |
| C、30mL | D、120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为8的N原子:
| ||
B、硫离子的结构示意图: | ||
| C、H2O2的结构式:H-O-O-H | ||
| D、石英的化学式:Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 固体催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
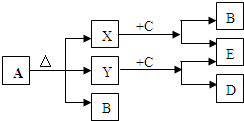 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如图所示,已知E为气体单质,能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:
 决定物质性质的重要因素是物质的结构.请回答下列问题:
决定物质性质的重要因素是物质的结构.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入到乙醇中 |
| B、红热的木炭投入到热的浓硝酸中 |
| C、电石投入到水中CaC2 |
| D、加热溴乙烷与NaOH乙醇溶液的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com