
用5mol/L的氯化钠溶液配制0.1mol/L的氯化钠溶液500mL,无需使用的仪器是( )
A.量筒 B.托盘天平 C.500mL容量瓶 D.胶头滴管
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:填空题
从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
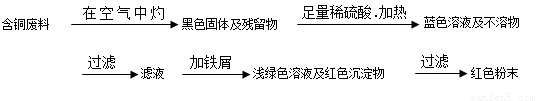
方案乙:
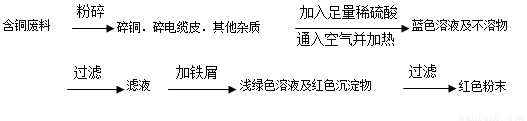
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________ _ ______。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3 溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ =Fe 3+ + Ce3+
计算上述样品中CuCl的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com