
| A、①-d | B、②-a |
| C、③-c | D、④-b |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
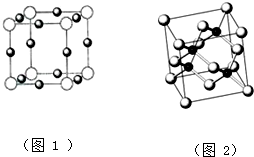
| 实验操作 | 实验现象 | 结论 | |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | |||
| ②过滤,取2mL滤液于试管中 | |||
| ③ | |||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①和② |
| B、只有②和③ |
| C、只有①、②和③ |
| D、①②③④全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为解决城市缺水问题,应将废水处理后循环使用 |
| B、为解决空气污染问题,应积极开发使用太阳能等新能源,减少化石燃料的使用 |
| C、为解决水土流失问题,应促进生态保护和修复 |
| D、为解决白色污染问题,应将废弃塑料收集、焚烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气 质量状况 | ||
| 二氧化硫 | 二氧化氮 | 可吸入颗粒物 | |||
| 12 | 33 | 66 | 2 | 良 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
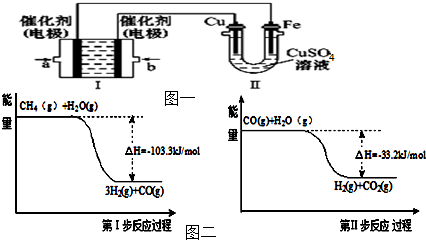
查看答案和解析>>
科目:高中化学 来源: 题型:
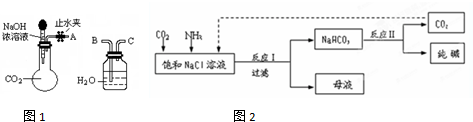
 氮族元素的单质及其化合物的应用较为广泛.请回答下列问题:
氮族元素的单质及其化合物的应用较为广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
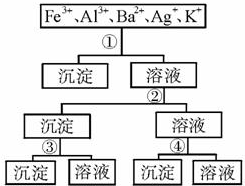 用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题如图所示步骤分开五种离子.则溶液①、②、③、④是( )
用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题如图所示步骤分开五种离子.则溶液①、②、③、④是( )| A、①NaCl ②NaOH ③NH2?H2O ④H2SO4 |
| B、①H2SO4 ②NaOH ③NH3?H2O ④NaCl |
| C、①H2SO4 ②NH3?H2O ③NaOH ④NaCl |
| D、①NaCl ②NH3?H2O ③NaOH ④H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com