
”¾ĢāÄæ”æX”¢Y”¢Z”¢Q”¢RŹĒĪåÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó£®X”¢YĮ½ŌŖĖŲ×īøßÕż¼ŪÓė×īµĶøŗ¼ŪÖ®ŗĶ¾łĪŖ0£»QÓėXĶ¬Ö÷×壻Z”¢R·Ö±šŹĒµŲæĒÖŠŗ¬Įæ×īøߵķĒ½šŹōŌŖĖŲŗĶ½šŹōŌŖĖŲ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĪåÖÖŌŖĖŲŌ×Ó°ė¾¶Óɓ󵽊”µÄĖ³ŠņŹĒ£ØŠ“ŌŖĖŲ·ūŗÅ£© £®
£Ø2£©XÓėYÄÜŠĪ³É¶ąÖÖ»ÆŗĻĪļ£¬ĘäÖŠ¼Čŗ¬¼«ŠŌ¼üÓÖŗ¬·Ē¼«ŠŌ¼ü£¬ĒŅĻą¶Ō·Ö×ÓÖŹĮæ×īŠ”µÄĪļÖŹ£ØŠ“·Ö×ÓŹ½£© £®
£Ø3£©ÓÉŅŌÉĻijŠ©ŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļA”¢B”¢C”¢DÓŠČēĻĀ×Ŗ»Æ¹ŲĻµA ![]() B£ØŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£©£¬ĘäÖŠCŹĒČÜÓŚĖ®ĻŌĖįŠŌµÄĘųĢ壻DŹĒµ»ĘÉ«¹ĢĢ壮Š“³öCµÄ½į¹¹Ź½£»DµÄµē×ÓŹ½ £® Čē¹ūA”¢B¾łÓÉČżÖÖŌŖĖŲ×é³É£¬BĪŖĮ½ŠŌ²»ČÜĪļ£¬ŌņAµÄ»ÆѧŹ½ĪŖ £¬ ÓÉA×Ŗ»ÆĪŖBµÄĄė×Ó·½³ĢŹ½ĪŖ £®
B£ØŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£©£¬ĘäÖŠCŹĒČÜÓŚĖ®ĻŌĖįŠŌµÄĘųĢ壻DŹĒµ»ĘÉ«¹ĢĢ壮Š“³öCµÄ½į¹¹Ź½£»DµÄµē×ÓŹ½ £® Čē¹ūA”¢B¾łÓÉČżÖÖŌŖĖŲ×é³É£¬BĪŖĮ½ŠŌ²»ČÜĪļ£¬ŌņAµÄ»ÆѧŹ½ĪŖ £¬ ÓÉA×Ŗ»ÆĪŖBµÄĄė×Ó·½³ĢŹ½ĪŖ £®
”¾“š°ø”æ
£Ø1£©Na£¾Al£¾C£¾O£¾H
£Ø2£©C2H2
£Ø3£©O=C=O£»![]() £»NaAlO2£»AlO2©+2H2O+CO2=Al£ØOH£©3+HCO3©»ņ2AlO2©+3H2O+CO2=2 Al£ØOH£©3+CO32©
£»NaAlO2£»AlO2©+2H2O+CO2=Al£ØOH£©3+HCO3©»ņ2AlO2©+3H2O+CO2=2 Al£ØOH£©3+CO32©
”¾½āĪö”æ½ā£ŗX”¢Y”¢Z”¢Q”¢RŹĒĪåÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó£®Z”¢R·Ö±šŹĒµŲæĒÖŠŗ¬Įæ×īøߵķĒ½šŹōŌŖĖŲŗĶ½šŹōŌŖĖŲ£¬ŌņZĪŖOŌŖĖŲ”¢RĪŖAl£»X”¢YŌŖĖŲ×īøßÕż¼ŪÓė×īµĶøŗ¼ŪÖ®ŗĶ¾łĪŖ0£¬ĒāŌŖĖŲ”¢¢ōA×åŌŖĖŲ·ūŗĻ£¬ÓÉŌ×ÓŠņŹżæÉÖŖ£¬XĪŖHŌŖĖŲ£¬YĪŖCŌŖĖŲ£»QÓėXĶ¬Ö÷×壬QŌ×ÓŠņŹż“óÓŚŃõ£¬æÉÖŖQĪŖNa£®£Ø1£©ĖłÓŠŌŖĖŲÖŠHŌ×Ó°ė¾¶×īŠ”£¬Ķ¬ÖÜĘŚ×Ō×ó¶ųÓŅŌ×Ó°ė¾¶¼õŠ””¢Ķ¬Ö÷×å×ŌÉĻ¶ųĻĀŌ×Ó°ė¾¶Ōö“󣬹ŹŌ×Ó°ė¾¶£ŗNa£¾Al£¾C£¾O£¾H£¬ĖłŅŌ“š°øŹĒ£ŗNa£¾Al£¾C£¾O£¾H£»£Ø2£©ĒāÓėĢ¼ÄÜŠĪ³É¶ąÖÖ»ÆŗĻĪļ£¬ĘäÖŠ¼Čŗ¬¼«ŠŌ¼üÓÖŗ¬·Ē¼«ŠŌ¼ü£¬ĒŅĻą¶Ō·Ö×ÓÖŹĮæ×īŠ”µÄĪļÖŹĪŖC2H2 £¬
ĖłŅŌ“š°øŹĒ£ŗC2H2£»£Ø3£©ÉĻŹöĪåÖÖŌŖĖŲÖŠµÄČōøÉÖÖ×é³ÉµÄ»ÆŗĻĪļA”¢B”¢C”¢D£¬ĘäÖŠCŹĒČÜÓŚĖ®ĻŌĖįŠŌµÄĘųĢ壬DŹĒµ»ĘÉ«¹ĢĢ壬ŌņCĪŖCO2”¢DĪŖNa2O2 £¬ ŌņCO2µÄ½į¹¹Ź½ĪŖO=C=O£¬Na2O2µÄµē×ÓŹ½ĪŖ ![]() £¬
£¬
Čē¹ūA”¢B¾łÓÉČżÖÖŌŖĖŲ×é³É£¬BĪŖĮ½ŠŌ²»ČÜĪļ£¬½įŗĻ×Ŗ»Æ¹ŲĻµæÉÖŖ£¬AĪŖNaAlO2”¢BĪŖAl£ØOH£©3 £¬ Ę«ĀĮĖįøłÓė¶žŃõ»ÆĢ¼”¢Ė®·“Ӧɜ³ÉĒāŃõ»ÆĀĮÓėĢ¼Ėįøł£¬A×Ŗ»ÆĪŖBµÄ·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗAlO2©+2H2O+CO2=Al£ØOH£©3+HCO3©»ņ2 AlO2©+3 H2O+CO2=2 Al£ØOH£©3+CO32© £¬
ĖłŅŌ“š°øŹĒ£ŗO=C=O£» ![]() £»NaAlO2£»AlO2©+2H2O+CO2=Al£ØOH£©3+HCO3©»ņ2AlO2©+3H2O+CO2=2 Al£ØOH£©3+CO32© £®
£»NaAlO2£»AlO2©+2H2O+CO2=Al£ØOH£©3+HCO3©»ņ2AlO2©+3H2O+CO2=2 Al£ØOH£©3+CO32© £®


 ѧʌø“Ļ°Ņ»±¾ĶØѧĻ°×ܶÆŌ±ĘŚÄ©¼ÓŹī¼ŁŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ѧʌø“Ļ°Ņ»±¾ĶØѧĻ°×ܶÆŌ±ĘŚÄ©¼ÓŹī¼ŁŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø Ć¢¹ū½ĢøØŹī¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
Ć¢¹ū½ĢøØŹī¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2015ÄźÅµ±“¶ūÉśĄķѧ»ņŅ½Ń§½±µÄŅ»°ėŹŚÓčĪŅ¹śŅ©Īļ»Æѧ¼ŅĶĄßŗßŗ£¬ŅŌ±ķÕĆĖż·¢Ć÷æ¹Å±¼²ŠĀŅ©ĒąŻļĖŲŗĶĖ«ĒāĒąŻļĖŲ£®ŅŌŅģŗś±”ŗÉ“¼ĪŖĘšŹ¼ŌĮĻŹĒČĖ¹¤Č«ŗĻ³ÉĒąŻļĖŲµÄĶ¾¾¶Ö®Ņ»£ØČēĶ¼£©£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £© 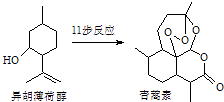
A.Ņģŗś±”ŗÉ“¼µÄ·Ö×ÓŹ½ĪŖC10H17O
B.Ņģŗś±”ŗÉ“¼ŌŚNaOH“¼ČÜŅŗÖŠæÉ·¢ÉśĻūČ„·“Ó¦
C.ĒąŻļĖŲ·Ö×ÓÖŠŗ¬ÓŠ7øöŹÖŠŌĢ¼Ō×Ó
D.ĒąŻļĖŲŌŚČȵÄĖį”¢¼īČÜŅŗÖŠ¾łæÉĪČ¶Ø“ęŌŚ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æAŗĶB¾łĪŖÄĘŃĪµÄĖ®ČÜŅŗ£¬A³ŹÖŠŠŌ£¬B³Ź¼īŠŌ²¢¾ßÓŠŃõ»ÆŠŌ”£ĻĀŹöĪŖĻą¹ŲŹµŃé²½ÖčŗĶŹµŃéĻÖĻó”£Ēė»Ų“š£ŗ

£Ø1£©Š“³öCµÄ»ÆѧŹ½£ŗ ____________£¬ÓĆĪÄ×ÖĆčŹöŹµŃéĻÖĻó1£ŗ______________________”£
£Ø2£©ŅĄ“ĪŠ“³öB”śFŗĶF”śHµÄ»Æѧ·½³ĢŹ½£ŗ _________________________________________________________£» _________________________________________________________”£
£Ø3£©A”śDÖ÷ŅŖ²Ł×÷²½ÖčČēĻĀĶ¼£ŗ

¼×£®¼ÓČėCCl4ŗóÕńµ“ ŅŅ£®¾²ÖĆ·Ö²ć ±ū£®·ÖĄė
¼×”¢ŅŅ”¢±ū3²½ŹµŃé²Ł×÷ÖŠ£¬²»ÕżČ·µÄŹĒ_______£ØĢī”°¼×”±”¢”°ŅŅ”±»ņ”°±ū”±£©”£
£Ø4£©½«SO2ĘųĢåĶØČėDČÜŅŗ£¬DČÜŅŗ±äĪŖĪŽÉ«£¬Éś³ÉĮ½ÖÖĖį”£Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_____________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶ¼ČÄÜÓėĻ”ĻõĖį·“Ó¦£¬Ņ²ÄÜÓėÅØĻõĖį·“Ó¦£¬µ±ĶÓėŅ»¶ØÅضČĻõĖį·“Ó¦Ź±£¬æɽ«·½³ĢŹ½±ķŹ¾ĪŖ£ŗCu+HNO3”śCu£ØNO3£©2+NO”ü+NO2”ü+H2O £Ø·½³ĢŹ½Ī“ÅäĘ½£¬²»æ¼ĀĒ 2NO2N2O4£©£®
£Ø1£©ĻõĖįŌŚøĆ·“Ó¦ÖŠĢåĻֵĊŌÖŹÓŠ £®
£Ø2£©Čē¹ū²Ī¼Ó·“Ó¦µÄCuŗĶHNO3µÄĪļÖŹµÄĮæÖ®±ČŹĒ3£ŗ10£¬Š“³ö²¢ÅäĘ½øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ £®
£Ø3£©0.004molCu±»ĻõĖįĶźČ«Čܽāŗó£¬CuŹ§Č„µÄµē×ÓŹżŹĒ £¬ Čē¹ūµĆµ½µÄNOŗĶNO2ĪļÖŹµÄĮæĻąĶ¬£¬Ōņ²Ī¼Ó·“Ó¦µÄĻõĖįµÄĪļÖŹµÄĮæŹĒ £¬ ŌŚ±ź×¼×“æöĻĀČō½«ŹÕ¼ÆNOŗĶNO2µÄ¼ÆĘųĘæµ¹Į¢ÓŚĖ®ÖŠ£¬ĶØČėŅ»¶ØĮæµÄŃõĘų³ä·Ö·“Ó¦ŗó·¢ĻÖĪŽĘųĢåŹ£Óą£¬ŌņĶØČėO2µÄĢå»żĪŖmL£»ĖłµĆČÜŅŗ£Ø¼ŁÉčČÜÖŹ²»Ą©É¢£©µÄĪļÖŹµÄĮæÅØ¶ČŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£æĪĶāŠ”×éĪŖ²ā¶ØijĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄĘ»ģŗĻĪļÖŠĢ¼ĖįÄʵÄÖŹĮæ·ÖŹż£¬¼×”¢ŅŅĮ½×éĶ¬Ń§·Ö±š½ųŠŠĮĖĻĀĮŠĻą¹ŲŹµŃ飮
·½°ø¢ń£®¼××éĶ¬Ń§ÓĆÖŹĮæ·Ø£¬°“ČēĶ¼1ĖłŹ¾µÄŹµŃéĮ÷³Ģ½ųŠŠŹµŃé£ŗ
£Ø1£©ŹµŃ鏱£¬Õō·¢½į¾§²Ł×÷ÖŠ£¬³żĮĖ¾Ę¾«µĘĶā£¬»¹ŅŖÓƵ½µÄŅĒĘ÷ŹĒ
£Ø2£©ÓŠĶ¬Ń§ČĻĪŖ”°¼ÓČėŹŹĮæŃĪĖį”±²»ŗĆ²ŁæŲ£¬Ó¦øÄĪŖ”°¹żĮæŃĪĖį”±£¬±ćÓŚ²Ł×÷ĒŅ²»Ó°Ļģ²ā¶ØµÄ×¼Č·ŠŌ£¬ÄćČĻĪŖ¶Ō»ņ“ķ £¬ ĪŖŹ²Ć“ £®
£Ø3£©ČōŹµŃéÖŠ²āµĆѳʷ֏ĮæĪŖ46.4g£¬¹ĢĢåÖŹĮæĪŖ40.95g£¬ŌņĢ¼ĖįÄʵÄÖŹĮæ·ÖŹżĪŖ £® £Ø±£Įō3Ī»ÓŠŠ§Źż×Ö£©
£Ø4£©Õō·¢½į¾§¹ż³ĢÖŠČōÓŠ¹ĢĢå·É½¦£¬²āµĆĢ¼ĖįÄʵÄÖŹĮæ·ÖŹż£ØĢīĘ«“ó Ę«Š” ĪŽÓ°Ļģ£©£®
£Ø5£©·½°ø¢ņ£ŗŅŅ×éĶ¬Ń§µÄÖ÷ŅŖŹµŃéĮ÷³ĢĶ¼ČēĶ¼2£ŗ
°“ČēĶ¼3ĖłŹ¾×°ÖĆ½ųŠŠŹµŃé£ŗ
ŌŚC֊װ¼īŹÆ»ŅĄ“ĪüŹÕ¾»»ÆŗóµÄĘųĢ壮D×°ÖƵÄ×÷ÓĆŹĒ £®
£Ø6£©ÓŠµÄĶ¬Ń§ČĻĪŖĪŖĮĖ¼õÉŁŹµŃéĪó²ī£¬ŌŚ·“Ó¦Ē°ŗó¶¼ĶØČėN2 £¬ ·“Ó¦ŗóĶØČėN2µÄÄæµÄŹĒ £®
£Ø7£©·½°ø¢ó£ŗĘųĢå·ÖĪö·Ø
°ŃŅ»¶ØĮæѳʷÓė×ćĮæĻ”ĮņĖį·“Ó¦ŗó£¬ÓĆČēĶ¼4×°ÖĆ²āĮæ²śÉśCO2ĘųĢåµÄĢå»ż£¬BČÜŅŗ×īŗĆ²ÉÓĆ£ØŅŌĻĀŃ”ĻīÖŠŃ”Ōń£©Ź¹²āĮæĪó²ī½ĻŠ”£®
a£®±„ŗĶĢ¼ĖįÄĘČÜŅŗ b£®±„ŗĶĢ¼ĖįĒāÄĘČÜŅŗ
c£®±„ŗĶĒāŃõ»ÆÄĘČÜŅŗ d£®±„ŗĶĮņĖįĶČÜŅŗ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉś²śÖŠ³£ŅŖæŲÖĘ»Æѧ·“Ó¦Ģõ¼žŌö“ó·“Ó¦ĖŁĀŹ£®ĻĀĮŠ“ėŹ©ÖŠ²»ÄܼÓæģ»Æѧ·“Ó¦ĖŁĀŹµÄŹĒ£Ø £©
A.¾”æÉÄÜŹ¹ÓĆĻ”ČÜŅŗ
B.Ń”ŌńŗĻŹŹµÄ“߻ƼĮ
C.ÄėĻø¹ĢĢå·“Ó¦Īļ
D.Ģįøß·“Ó¦ĢåĻµµÄĪĀ¶Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄĘ¼°Ęä»ÆŗĻĪļ¾ßÓŠ¹ć·ŗµÄÓĆĶ¾£®
£Ø1£©³£ĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.1mol/LµÄĻĀĮŠĪåÖÖÄĘŃĪČÜŅŗµÄpHČē±ķ£»
ČÜÖŹ | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
ÉĻŹöŃĪČÜŅŗÖŠµÄŅõĄė×Ó£¬½įŗĻĒāĄė×ÓÄÜĮ¦×īĒæµÄŹĒ£»øł¾Ż±ķÖŠŹż¾Ż£¬ÅØ¶Č¾łĪŖ0.01mol/LµÄĻĀĮŠĖÄÖÖĖįµÄČÜŅŗ·Ö±šĻ”ŹĶ100±¶£¬pH±ä»Æ×ī“óµÄŹĒ£ØĢīŠņŗÅ£©£®
A£®HCN B£®HClO C£®CH3COOH D£®H2CO3
£Ø2£©ÓŠ¢Ł100mL0.1mol/LĢ¼ĖįĒāÄĘ ¢Ś100mL0.1mol/LĢ¼ĖįÄĘĮ½ÖÖČÜŅŗ£¬ČÜŅŗÖŠĖ®µēĄė³öµÄĒāĄė×ÓøöŹż£ŗ¢Ł¢Ś£ØĢī”°£¾”±”°=”±”°£¼”±ĻĀĶ¬£©£»ČÜŅŗÖŠŅõĄė×ÓµÄĪļÖŹµÄĮæÅضČÖ®ŗĶ£ŗ¢Ł¢Ś£®
£Ø3£©ŹµŃéŹŅÖŠ³£ÓĆĒāŃõ»ÆÄĘĄ“½ųŠŠĻ“ĘųŗĶĢį“森 ¢Łµ±150mL1mol/LµÄĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ±źæöĻĀ2.24L¶žŃõ»ÆĢ¼Ź±£¬ĖłµĆČÜŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ£ŗ³£ĪĀĻĀ£¬ŌŚøĆČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖįÖĮÖŠŠŌŹ±£¬ČÜÖŹµÄÖ÷ŅŖ³É·ÖÓŠ£®
¢Ś¼øÖÖĄė×ÓæŖŹ¼³ĮµķŹ±µÄpHČē±ķ£ŗ
Ąė×Ó | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
µ±Ļņŗ¬ĻąĶ¬ÅضČCu2+”¢Mg2+”¢Fe2+µÄČÜŅŗÖŠµĪ¼ÓĒāŃõ»ÆÄĘČÜŅŗŹ±£¬£ØĢīĄė×Ó·ūŗÅ£©ĻČ³Įµķ£¬Ksp[Fe£ØOH£©3]Ksp[Mg£ØOH£©2]£ØĢī”°£¾”±”°=”±»ņ”°£¼”±£©£¬ŅŖŹ¹0.2mol/LĮņĖįĶČÜŅŗÖŠĶĄė×Ó³Įµķ½ĻĪŖĶźČ«£ØŹ¹ĶĄė×ÓÅØ¶Č½µÖĮŌĄ“µÄĒ§·ÖÖ®Ņ»£©£¬ŌņÓ¦ĻņČÜŅŗĄļ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗŹ¹ČÜŅŗpHĪŖ £® £Ø Ksp[Cu£ØOH£©2]=2”Į10©20 £©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗI2£Øaq£©+I©£Øaq£©I3©£Øaq£©£®Ä³I2”¢KI»ģŗĻČÜŅŗÖŠ£¬I3©µÄĪļÖŹµÄĮæÅضČc£ØI3©£©ÓėĪĀ¶ČTµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØĒśĻßÉĻČĪŗĪŅ»µć¶¼±ķŹ¾Ę½ŗāדĢ¬£©£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £© 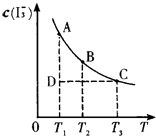
A.·“Ó¦I2£Øaq£©+I©£Øaq£©I3©£Øaq£©µÄ”÷H£¾0
B.ČōĪĀ¶ČĪŖT1”¢T2 £¬ ·“Ó¦µÄĘ½ŗā³£Źż·Ö±šĪŖK1”¢K2 £¬ ŌņK1£¼K2
C.Čō·“Ó¦½ųŠŠµ½×“Ģ¬DŹ±£¬Ņ»¶ØÓŠ¦ŌÕż£¾¦ŌÄę
D.דĢ¬AÓėדĢ¬BĻą±Č£¬×“Ģ¬AµÄc£ØI2£©“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŅĶ¼ĪŖŹµŃéŹŅÖĘȔɣĮæŅŅĖįŅŅõ„µÄ×°ÖĆĶ¼£®ĻĀĮŠ¹ŲÓŚøĆŹµŃéµÄŠšŹöÖŠ£¬²»ÕżČ·µÄŹĒ£Ø £© 
A.ĻņaŹŌ¹ÜÖŠĻČ¼ÓČėÅØĮņĖį£¬Č»ŗó±ßŅ”¶ÆŹŌ¹Ü±ßĀżĀż¼ÓČėŅŅ“¼£¬ŌŁ¼Ó±ł“×Ėį
B.ŹŌ¹ÜbÖŠµ¼Ęų¹ÜĻĀ¶Ė¹ÜæŚ²»ÄܽžČėŅŗĆęµÄÄæµÄŹĒ·ĄÖ¹ŹµŃé¹ż³ĢÖŠ²śÉśµ¹ĪüĻÖĻó
C.ŹµŃ鏱¼ÓČČŹŌ¹ÜaµÄÄæµÄÖ®Ņ»ŹĒ¼°Ź±½«ŅŅĖįŅŅõ„Õō³ö£¬Ź¹·“Ó¦ĻņÉś³ÉŅŅĖįŅŅõ„µÄ·½ĻņŅʶÆ
D.ŹŌ¹ÜbÖŠ±„ŗĶNa2CO3ČÜŅŗµÄ×÷ÓĆŹĒĪüŹÕĖęŅŅĖįŅŅõ„Õō³öµÄÉŁĮæŅŅĖįŗĶŅŅ“¼
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com