
【题目】(1)18.6g Na2X含有0.6mol Na+,则X的相对原子质量为_______,该物质的化学式为________。
(2)与0.2mol H2含有相同电子数目的氦气分子的物质的量为__________。
(3)标准状况下,1.6 g某气态氧化物RO2体积为0.56 L,该气体的物质的量为________mol,RO2的相对分子质量为__________。
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75 g/L,该混合气体的平均摩尔质量为__________,该气体对氢气的相对密度为__________,NH3的体积分数为__________。
(5)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(6)相同条件下,H2和O2的体积比为m∶n和质量比为m∶n的混合气体,其平均相对分子质量分别是_______________和______________。
【答案】16Na2O0.2 mol0.025 mol6416.8 g/mol8.480%![]() L
L![]()
![]()
【解析】
(1)Na2X中含有0.4molNa+,Na2X的物质的量为0.2mol,则Na2X的摩尔质量=![]() =62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为: 16;Na2O;
=62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为: 16;Na2O;
(2)与0.2mol H2含有电子0.2mol×2=0.4mol,含有相同电子数目的氦气的物质的量为![]() =0.2mol,故答案为:0.2mol;
=0.2mol,故答案为:0.2mol;
(3)标准状况下,Vm=222.4L/mol,1.6g某气态氧化物RO2的体积为0.56L,其物质的量为![]() =0.025mol,其摩尔质量为
=0.025mol,其摩尔质量为![]() =64g/mol,故RO2的相对分子质量为64,故答案为:0.025mol;64;
=64g/mol,故RO2的相对分子质量为64,故答案为:0.025mol;64;
(4)混合气体在标准状况下的密度为0.75g/L,则混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol,根据十字交叉法计算混合气体中NH3和CH4的体积比: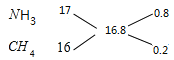 ,所以混合气体中NH3和CH4的体积比为0.8∶0.2=4∶1;即氨气的体积分数=
,所以混合气体中NH3和CH4的体积比为0.8∶0.2=4∶1;即氨气的体积分数=![]() ×100%=80%;由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为
×100%=80%;由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为![]() =8.4,故答案为: 16.8g/mol;8.4; 80%;
=8.4,故答案为: 16.8g/mol;8.4; 80%;
(5)a克某气体中含有的分子数为b,则c克气体含有的分子数为![]() ,c克该气体的物质的量为
,c克该气体的物质的量为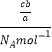 =
=![]() mol,在标准状况下,cg气体的体积=
mol,在标准状况下,cg气体的体积=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故答案为:
L,故答案为:![]() L;
L;
(6)平均摩尔质量为:M=![]() ,相同条件下,氢气和氧气的体积比为m∶n,物质的量之比为m∶n,二者平均摩尔质量为
,相同条件下,氢气和氧气的体积比为m∶n,物质的量之比为m∶n,二者平均摩尔质量为![]() g/mol,相对分子量为
g/mol,相对分子量为![]() ;质量比m∶n的H2和O2的混合气体,物质的量之比为
;质量比m∶n的H2和O2的混合气体,物质的量之比为![]() ∶
∶![]() =16m∶n,平均摩尔质量为
=16m∶n,平均摩尔质量为![]() g/mol=
g/mol=![]() g/mol,平均分子量为
g/mol,平均分子量为![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因在开发多尺度复杂化学系统模型方面所做的贡献,而获得了诺贝尔化学奖。他们模拟出了1,6—二苯基—1,3,5—己三烯的分子模型,其结构简式如图所示。下列说法正确的是

A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1mol 该有机物在常温下最多能与6 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置欲验证CaSO4与炭粉受热发生氧化还原反应,且还原产物是SO2。下列有关说法不正确的是
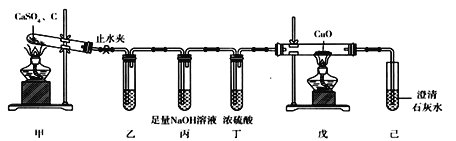
A. 装置乙欲验证气体中的还原产物,故乙中盛有CaSO4溶液
B. 装置丙和装置丁的作用是除去SO2和其他杂质气体
C. 装置戊中黑色粉末变红,己中出现白色沉淀,说明氧化产物有CO
D. 实验结束时,应该先关闭止水夹,再迅速熄灭装置甲中的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。
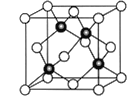
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com