
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
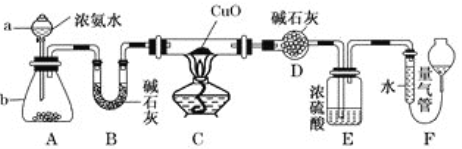
(1)仪器b中的试剂可能为__________________。
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,上述现象证明NH3具有____________性,写出相应的化学方程式_____________________________________。
(3)E装置中浓硫酸的作用______________________________________________。
(4)读取气体体积前,应对装置F进行的操作:_______________________。
(5)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n字母的代数式表示)。
【答案】氧化钙或氢氧化钠固体或碱石灰 还原 3CuO+2NH3![]() 3Cu+3H2O+N2 吸收未反应的氨气,阻止F中水蒸气进入D 慢慢上下移动右边漏斗,使左右两管液面相平 9n/11.2m
3Cu+3H2O+N2 吸收未反应的氨气,阻止F中水蒸气进入D 慢慢上下移动右边漏斗,使左右两管液面相平 9n/11.2m
【解析】
(1)浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氧化铜做氧化剂氧化氨气生成铜、氮气和水;
(3)E装置中浓硫酸的作用依据装置图分析判断是利用浓硫酸吸收过量氨气,同时避免F装置中的水蒸气进入D;
(4)依据量气管的使用方法回答;
(5)干燥管D增重mg为反应生成的水,装置F测得气体的体积为nL为反应生成的氮气;依据元素守恒计算得到。
(1)仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3![]() 3Cu+3H2O+N2。
3Cu+3H2O+N2。
(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果;
(5)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;
(6)若测得干燥管D增重mg为水物质的量=![]() ,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=
,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=![]() ,依据元素守恒得到氮原子和氢原子物质的量之比=
,依据元素守恒得到氮原子和氢原子物质的量之比=![]() ×2:
×2:![]() ×2=
×2=![]() ,则氨分子中氮、氢的原子个数比为
,则氨分子中氮、氢的原子个数比为![]() 。
。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为___________。
(2)0.1 mol 烷烃E完全燃烧,消耗标准状况下的O211.2 L,其分子式为___________。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为____________。
(4)某有机物的结构表达式为![]() ,其名称是_______________。
,其名称是_______________。
(5)萘的结构式为![]() ,其分子式为 ,它的二氯代物又有 种。
,其分子式为 ,它的二氯代物又有 种。
(6)立方烷![]() 其分子式为 ,它的六氯代物有 种。
其分子式为 ,它的六氯代物有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是____。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是____。
(3)高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是( )

A.CaC2晶体的熔点较高、硬度也较大
B.和Ca2+距离相同且最近的C22-构成的多面体是正八面体
C.和Ca2+距离相同且最近的Ca2+有12个
D.如图的结构中共含有4个Ca2+和4个C22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素,能够治疗坏血病并且具有酸性,所以俗称作抗坏血酸。具体合成路线如图所示:
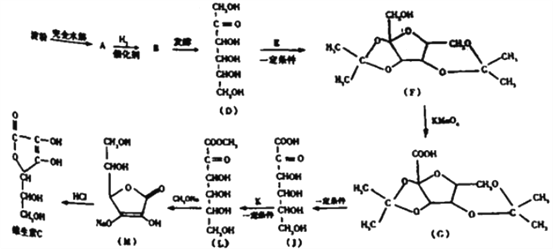
(1)下列说法不正确的是_____________
a.从结构上看维生素C不稳定,在受热、光照和长时间放置会变质
b.合成路线中的物质A、B、D都属于单质
c.用银镜反应不能判断淀粉水解是否完全
d.发酵的过程实际上是消去反应
e.图中的“一定条件”可能是“浓硫酸
(2)维生素C分子中含有的含氧官能团名称为:__________。
(3)核磁共振氢谱检验E只含有一种氢,则E的结构简式为_____,此步反应的目的是____。
(4)用新制氢氧化铜悬浊液检验A的实验现象为:_______,发生反应的化学方程式为:____。
(5)J的一种环状的同分异构体能发生水解反应和银镜反应,且含有6不同环境的氢,请写出该同分异构体可能的结构简式: ________(任写1种).
(6)参照上述合成路线设计以下合成路线:_________________
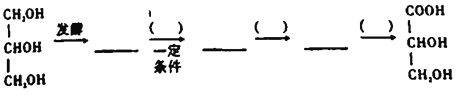
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(1)元素X在元素周期表中的位置是_______。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_________,所含化学键的类型有离子键、____
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为________
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为_______
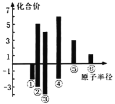
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是_____,发生反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.Fe(OH)3溶于氢碘酸: Fe(OH)3 + 3H+ =Fe3+ + 3H2O
C.泡沫灭火器灭火原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
D.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH4++ HCO3-![]() NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com