
已知下列热化学方程式:①H2(g)+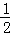 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+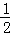 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+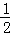 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
考点: 反应热和焓变;有关反应热的计算;热化学方程式.
专题: 化学反应中的能量变化.
分析: (1)燃烧热是指在25摄氏度,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定氧化物据此解答;
(2)依据氢气燃烧的热化学方程式计算;
(3)依据盖斯定律解答.
解答: 解:(1)根据燃烧热的定义,1mol氢气燃烧生成液态水更稳定,所以①H2(g)+ O2(g)=H2O(l);△H=﹣285kJ•mol﹣1;为氢气燃烧热的化学方程式,所以氢气的燃烧热为:﹣285kJ•mol﹣1;根据燃烧热的定义,1mol碳完全燃烧生成二氧化碳时放出的热量为碳的燃烧热,④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1,为碳燃烧热的化学方程式,所以碳的燃烧热为:﹣393.5kJ•mol﹣1;
O2(g)=H2O(l);△H=﹣285kJ•mol﹣1;为氢气燃烧热的化学方程式,所以氢气的燃烧热为:﹣285kJ•mol﹣1;根据燃烧热的定义,1mol碳完全燃烧生成二氧化碳时放出的热量为碳的燃烧热,④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1,为碳燃烧热的化学方程式,所以碳的燃烧热为:﹣393.5kJ•mol﹣1;
故答案为:﹣285kJ•mol﹣1;﹣393.5kJ•mol﹣1;
(2)H2(g)+ O2(g)=H2O Q
O2(g)=H2O Q
2g 285kJ
1g 142.5KJ
所以燃烧1gH2生成液态水,放出的热量为142.5KJ,
故答案为:142.5KJ;
(3)已知③C(s)+ O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
据盖斯定律,(④﹣③)×2得:2CO(g)+O2(g)=2CO2(g)△H=﹣566KJ/mol,
故答案为:2CO(g)+O2(g)=2CO2(g)△H=﹣566KJ/mol.
点评: 本题考查了燃烧热的定义和反应热的求算以及热化学方程式书写,题目难度不大,理解燃烧热概念时注意:
1、物质的物质的量必须是1mol;2、必须是完全燃烧生成稳定的氧化物.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列5 项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液; ⑤加过量的氯化钡溶液.下列正确的操作顺序是()
A. ①④②⑤③ B. ⑤②①④③ C. ④①②⑤③ D. ②⑤④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是()
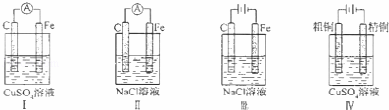
A. 实验Ⅰ:电流表A指针偏转,碳棒上有气泡冒出
B. 实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜溶解,精铜上有红色固体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
向10mL 0.1mol•L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是()
A. x=10时,溶液中有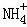 、Al3+、
、Al3+、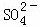 ,且c(
,且c(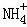 )=c(Al3+)
)=c(Al3+)
B. x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C. x=30时,溶液中有Ba2+、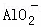 、OH﹣,且c(OH﹣)>c(
、OH﹣,且c(OH﹣)>c(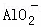 )
)
D. 滴加过程中,生成沉淀的最大物质的量为0.003mol
查看答案和解析>>
科目:高中化学 来源: 题型:
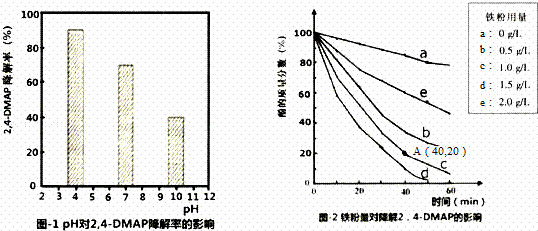
利用Na2S2O8产生的强氧化性SO4﹣•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4﹣DMAP(2,4﹣﹣甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4﹣DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强, (填“有利于”或“不利于”)Na2S2O8产生SO4﹣•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L﹣1 H2SO4洗涤Fe粉,其目的是 ,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4﹣DMAP)=1.0×10 ﹣3mol•L﹣1、c(Na2S2O8)=4.2×10﹣3mol•L﹣1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4﹣DMAP降解的平均反应速率为 (忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH﹣,S2O8﹣+Fe2+=SO4﹣+SO42﹣+Fe3+此外还可能会发生:SO4﹣+Fe2+=SO42﹣+Fe3+.当铁粉加入量过大时,2,4﹣DMAP的降解率反而下降,原因可能是(用离子方程式表示). .
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
序号、物理量 M(Fe粉)/g V/mL V/mL 收集数据和得出结论
1 100 0.3 50 50
2 100V(污水)/mL 0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()
A. Cu能与浓硝酸反应,而不与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Fe与浓盐酸反应快,与稀盐酸反应慢
查看答案和解析>>
科目:高中化学 来源: 题型:
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com