
| A. | Al | B. | Mg | C. | Cu | D. | Au |
科目:高中化学 来源: 题型:选择题

| A. | 用图1示装置制备Cl2 | |
| B. | 将混合气体通过装有NaOH溶液的洗气瓶除去Cl2中混有的HCl | |
| C. | 用图2示装置分离CH3COOC2H5与饱和Na2CO3溶液 | |
| D. | 称取1.06 g Na2CO3固体,置于100 mL容量瓶中,加水稀释,配制0.10 mol•L-1的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(CO):通过灼热的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加盐酸 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
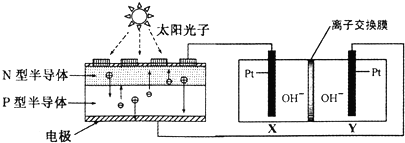
| A. | 图中N型半导体为正极,P型半导体为负极 | |
| B. | 图中离子交换膜为阳离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O═CO+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2、18O3互为同位素 | |
| B. | 次氯酸的电子式为 | |
| C. | 氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com