
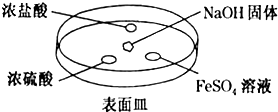

分析 I.(1)①氨气与氯化氢反应生成固体氯化铵,产生大量白烟;
②氨气与浓硫酸反应生成硫酸铵或硫酸氢铵;
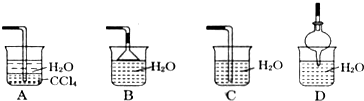
(2)根据氨气极易溶于水,尾气吸收时要防止倒吸,导气管不能插入到液面以下以及氨气难溶于有机溶剂CCl4.
Ⅱ.(1)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈;
(2)氨水是弱碱,用盐酸滴定恰好反应生成氯化铵溶液,铵根离子水解显酸性,甲基橙指示剂变色范围3.1-4.4,酸中为红色,碱中为黄色,变色范围内为橙色;
可以用移液管或碱式滴定管量取碱性溶液;
(3)氨气极易溶于水,三颈瓶中氨气溶于水形成喷泉充满整个三颈瓶,氨水的物质的量浓度C=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨;
(4)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,读取标准溶液体积增大;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸溶液体积偏小.
解答 解:I.(1)①氨气与氯化氢反应生成固体氯化铵,反应的化学方程式为:NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
②浓硫酸难挥发,能与氨气反应生成硫酸盐,则一段时间后浓硫酸的液滴中生成的白色固体为NH4HSO4或(NH4)2SO4,
故答案为:NH4HSO4或(NH4)2SO4;
(2)A.水的密度比四氯化碳小,浮在四氯化碳的上面,四氯化碳不能和氨气反应,也不溶解氨气,该装置既能够吸收易溶性气体,又能够防止倒吸.故A正确;
B.吸收装置中的导管下连漏斗,漏斗的边缘紧靠液面,易吸收易溶性气体,能防止倒吸,故B正确;
C.吸收装置中的导气管插入到液面,易吸收易溶性气体,但产生倒吸,故C错误;
D.吸收装置中的导管没直接伸入到液体中,而是与烧杯连接紧密,易吸收易溶性气体,能防止倒吸,故D正确;
故选:C.
Ⅱ.(1)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和D点压强差最大,则喷泉越剧烈,故答案为:D;
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入甲基橙指示剂,在碱溶液中是黄色,PH变色范围为:3.1-4.4,用0.0500mol•L-1HCl滴定.终点时溶液颜色由黄色变化为橙色,
故答案为:甲基橙,黄,橙;
(3)氨气极易溶于水,三颈瓶中氨气溶于水形成喷泉充满整个三颈瓶,设三颈瓶体积为1L,所以氨水的物质的量浓度C=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨,一水合氨电离大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:0.0450;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液浓度和待测溶液体积是恒定数值,分析操作归结为标准溶液的体积变化来判断待测溶液的浓度变化,
A.锥形瓶中有少量蒸馏水,待测溶液浓度稀释,溶质物质的量不变,对测定结果无影响,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,消耗标准溶液盐酸的体积增大,测得氨水的浓度偏高,故B正确;
C.酸式滴定管未用盐酸润洗会导致标准溶液浓度减小,测得氨水的浓度偏高,故C正确;
D.滴定终点时俯视读数,读取标准溶液的体积会偏小,导致测得氨水的浓度偏低,故D正确;
故答案为:BCD;
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确滴定原理、喷泉实验原理、弱电解质电离等知识点是解本题关键,中和滴定的步骤和误差分析方法,题目难度中等.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
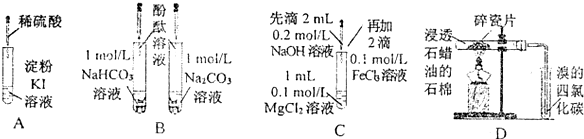
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
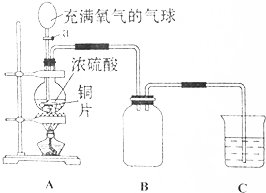 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 将稀硝酸加入过量铁粉中,充分反应后滴加硫氰化钾溶液,有气体生成溶液呈血红色,说明稀硝酸将铁氧化为正三价铁离子 | |
| D. | 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,熔化后的液态铝不会滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全燃烧生成二氧化碳和水的化合物不一定是烃 | |
| B. | 相同质量的正丁烷和异丁烷分别完全燃烧,耗氧量相等 | |
| C. | 相同物质的量乙烯和乙醇分别完全燃烧,耗氧量相等 | |
| D. | 相同质量的乙烷和乙炔分别完全燃烧,耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:计算题
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(1)若某可逆反应的化学平衡常数表达式为:K=C(CO)·C(H2)/C(H2O)
写出该反应的化学方程式:_____________________。
(2) CO(g)+H2O(g) CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状
CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状 态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com