
【题目】设NA为阿伏加德罗常数的值, 下列说法正确的是( )
A. 常温下,将5. 6g铁片投入足量浓硝酸中生成6. 72L NO2气体
B. 1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C. 标准状况下,11.2L的二氯甲烷所含的分子数为0. 5NA
D. 常温常压下,28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
科目:高中化学 来源: 题型:
【题目】将足量的新制氯水分别滴加到下列溶液或滤纸上,对所观察到的现象描述合理的一组是
AgNO3溶液 | 蓝色石蕊试纸 | Na2CO3溶液 | |
A | 产生沉淀 | 变红后无现象 | 有气泡 |
B | 无明显现象 | 变红后无现象 | 产生沉淀 |
C | 产生沉淀 | 先变红后褪色 | 有气泡 |
D | 产生沉淀 | 先变红后褪色 | 产生沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M为原子序数依次增大的短周期元素,周期表中X原子半径最小,Y元素形成化合物种类最多,Z元素的氢化物水溶液呈碱性,常温下L可以形成两种液态氢化物,M的最高价氧化物对应的水化物呈两性。回答下列问题:
(1)L元素形成单质的名称为______;M在元素周期表中的位置为____;五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为______。
(3)写出由X、Z、L三种元素组成的离子化合物与稀的NaOH溶液加热反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
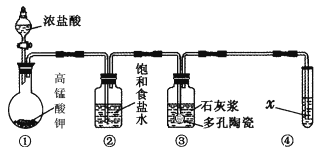
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
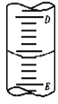
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )

A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
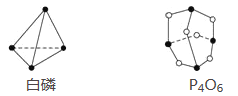
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于油和脂肪的比较,错误的说法是 ( )。
A.油的熔点低,脂肪的熔点高
B.油含不饱和烃基的相对量比脂肪少
C.油和脂肪都不易溶于水,易溶于汽油、酒精、苯等有机溶剂
D.油经过氢化可以转化为脂肪,通常又叫做硬化油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com