
(16分)Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 = -393.5 kJ/mol
CO2(g) ΔH1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 = -571.6 kJ/mol
2H2O(l) ΔH 3 = -571.6 kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 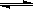 2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2 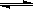 2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
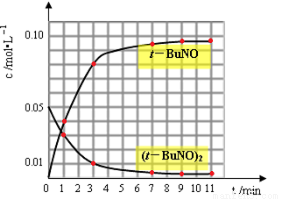
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
(16分)
Ⅰ.-488.3kJ/mol
Ⅱ.(1)ν(t-BuNO)=0.06mol?L-1?min-1
【解析】
(t-BuNO)2  2(t-BuNO)
2(t-BuNO)
开始浓度(mol?L-1) 0.50 0
转化浓度(mol?L-1) 0.50×60% 0.50×60%×2
平衡浓度(mol?L-1) 0.50×(1-60%) 0.50×60%×2
K=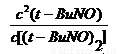 =
= =1.80mol/L
=1.80mol/L
(2)C
(3)
Ⅲ.CH3OH + 8OH- -6 e-= CO32- + 6H2O 4
【解析】
试题分析:Ⅰ、根据盖斯定律,2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为ΔH4==ΔH 1×2+ΔH 3×2-ΔH 2=-488.3 kJ/mol。Ⅱ、(1)已知(t-BuNO)2的初始物质的量为0.5mol及体积为1L,可求得其初始浓度为0.50mol/L,同时知道,(t-BuNO)2的转化率为60%,△c((t-BuNO)2)=0.3 mol/L,由方程式可知:v(t-BuNO)=2 v(t-BuNO)2=2×[(0.3mol/L)÷10min]= 0.06mol?L-1?min-1;利用三段式计算K值:
(t-BuNO)2  2(t-BuNO)
2(t-BuNO)
开始浓度(mol?L-1) 0.50 0
转化浓度(mol?L-1) 0.50×60% 0.50×60%×2
平衡浓度(mol?L-1) 0.50×(1-60%) 0.50×60%×2
可解得:K=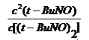 =
=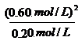 =1.80mol/L
=1.80mol/L
(2)A、由于该反应为非气体反应体系,改变压强,平衡不移动,反应物的转化率不变,错误;B、由于题目中的改变温度,无法知道该反应的热效应,改变温度,无法知道其移动方向,错误;C、该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L,在(1)中计算得在正庚烷溶剂中的平衡常数为1.80mol/L,故不同溶剂中的平衡常数K值不同,正确,应选择C;(3)根据40℃时浓度随时间的变化关系数据表格,在图中进行描点,然后连城曲线,并做好标注,即可:Ⅲ、燃料电池中通入燃料的一极为负极,而通入O2的一极为正极,由于电解质溶液是KOH溶液,显碱性,可得总反应为:2CH3OH+3O2 + 4OH- =2 CO32- + 6H2O,正极反应为O2 + 4 e-+ 2H2O =4OH-由总反应减去正极反应可得负极反应:CH3OH + 8OH- -6 e-= CO32- + 6H2O,注意得失电子数目相等;32g O2的物质的量即为1mol,根据上述正极反应方程式可计算出转移了4 mol e-。
考点:考查盖斯定律的应用、化学反应速率的计算、平衡常数的计算、化学平衡的影响因素、绘制平衡图像以及燃料电池电极反应式的书写和电子转移数目的计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列关于金属及其化合物的叙述正确的是
A.Fe与S混合加热生成FeS2
B.过量的Cu与浓硝酸会有NO生成
C.NaHCO3、Na2CO3、MgCO3受热均能分解生成气体
D.Na2O2与水反应、红热的Fe与水蒸气反应均能反应生成碱
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:填空题
(16分)废旧锂离子电池的正极材料(主要含有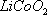 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
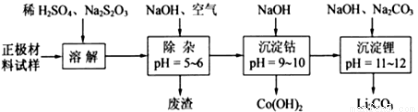
已知:Fe3+开始沉淀pH=2.7, 完全沉淀pH=3.2; Al3+开始沉淀pH=3.8, 完全沉淀pH=5.2; Co2+完全沉淀pH=9.15
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 ,氧化剂是_________________________________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式是______________ 废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________、_________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标况下,11.2L SO3所含的分子数目为0.5 NA
B.室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA
C.铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA
D.8 Al + 3NH4ClO4 =4 Al2O3 +3NH3 +3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量—27)
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
类推是学习和研究的重要思维方法。下列类推结论正确的是
| 化学事实 | 类推结论 |
A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
B | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
C | 用电解熔融MgCl2的方法冶炼金属镁 | 用电解熔融NaCl的方法制取金属钠 |
D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) △H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l) △H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO (g) + H2O (l) △H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
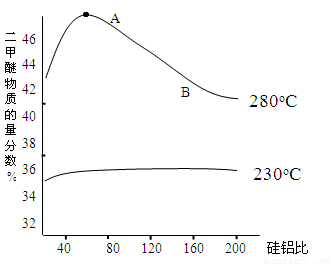
反应③的平衡常数表达式为 ,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律: ___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
A.NaHCO3 Na2CO3 BaCl2
B.KOH Na2SO4 AlCl3
C.KHCO3 NaHSO4
D.Ca(OH)2 Na2SO3 BaCl2
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下述实验设计能够达到目的的是( )
选项 | 实验目的 | 实验设计 |
A | 证明SO2有漂白性 | 把SO2通入品红溶液中 |
B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com