
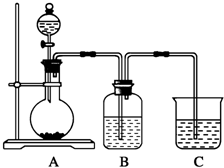
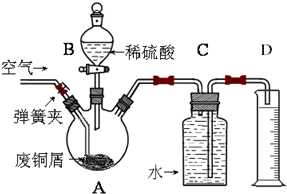
 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.分析 实验Ⅰ:元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,A中反应是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳;B装置是为了吸收挥发出的硝酸蒸气,避免证明碳的非金属性大于硅的实验,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅.
(1)A中反应是碳酸钙和稀硝酸反应生成二氧化碳,证明氮非金属性大于碳;C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅;
(2)B装置是为了吸收挥发出的硝酸蒸气,避免证明碳的非金属性大于硅的实验;
(3)根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知C、N、Si三种元素非金属性的强弱;
实验Ⅱ:探究氯、溴的非金属性强弱的递变规律,根据实验装置图可知,实验原理为A装置:浓盐酸与高锰酸钾反应生成氯气,氯气通入装置B:溴化钾溶液中,溶液出现红色,有溴单质生成,说明氯的非金属性强于溴,装置中挥发出来的溴或氯气都有毒,会污染空气,所以要用装置C:氢氧化钠溶液吸收.
(4)氯气通入溴化钾溶液中,溴离子被氯气氧化成溴单质,据此书写离子方程式;
(5)吸收尾气.
解答 解:实验Ⅰ:(1)A中反应是碳酸钙和稀硝酸反应生成二氧化碳,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,根据强酸制取弱酸的原理,硝酸的酸性强于碳酸,硝酸、碳酸分别为N、C的最高价含氧酸,所以可证明氮非金属性大于碳,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,根据强酸制取弱酸的原理,碳酸的酸性强于硅酸,碳酸、硅酸分别为C、Si的最高价含氧酸,所以可证明碳的非金属性大于硅,C装置中观察到溶液变浑浊,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;溶液变浑浊;
(2)硝酸易挥发,制取的二氧化碳中含有硝酸,若不除去硝酸,无法说明C装置中观察到溶液变浑浊是硝酸和硅酸盐反应,还是碳酸和硅酸盐反应,所以B装置是为了吸收挥发出的硝酸蒸气,
故答案为:除去二氧化碳中混有的硝酸蒸气;
(3)A中反应是碳酸钙和稀硝酸反应生成二氧化碳,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳酸的酸性强于硅酸,所以碳酸、硝酸、硅酸的酸性强弱顺序是硝酸、碳酸、硅酸,根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知C、N、Si三种元素非金属性的强弱为N>C>Si,
故答案为:硝酸、碳酸、硅酸;N>C>Si.
实验Ⅱ:(4)A装置:浓盐酸与高锰酸钾反应生成氯气2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,氯气通入装置B:溴化钾溶液中,2Br-+Cl2?Br2+2Cl-溶液出现红色,有溴单质生成,说明氯的非金属性强于溴,
故答案为:2Br-+Cl2?Br2+2Cl-;
(5)装置中挥发出来的溴或氯气都有毒,会污染空气,氢氧化钠能吸收溴单质、氯气,所以要用装置C:氢氧化钠溶液吸收,故答案为:吸收尾气.
点评 本题考查了实验设计和实验分析的判断,主要是非金属性强弱的判断依据,掌握物质性质和实验设计是解题关键,题目难度中等,注意把握比较金属性、非金属性的角度,把握实验方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
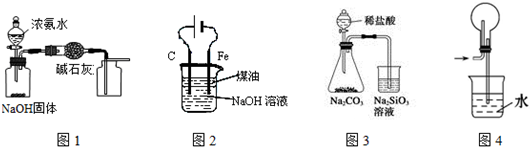
| A. | 用图1装置制取干燥纯净的NH3 | |
| B. | 用图2装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 装置3可证明非金属性Cl>C>Si | |
| D. | 装置4用于HCl的吸收,防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素按原子序数大小排列而成的 | |
| B. | 元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 元素原子的最外层电子数等于其所在族的族序数 | |
| D. | 元素周期表中共有18列,16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 碱性 Mg(OH)2<NaOH<KOH | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | Cl和Br属于ⅦA族元素,两原子核外电子数之差为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 或
或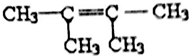 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过硫酸:
过硫酸: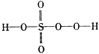
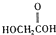 (b)
(b)  (c) H2O2 (d)
(c) H2O2 (d) 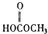
 (f)
(f)  (g) O2 (h)
(g) O2 (h) 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com