
取相同体积(250 mL)的两份0.01 mol/L NaOH溶液,把其中一份放在空气一段时间后,溶液的pH________(填“增大”、“减小”或“不变”),其原因是________.用已知浓度的硫酸溶液滴定上述两份溶液,其中第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为Va,另一份消耗硫酸溶液的体积为Vb,则
(1)以甲基橙为指示剂时Va与Vb的关系是________,以酚酞为指示剂时Va与Vb的关系是________.
(2)滴定过程主要的仪器有________.
(3)某学生中和滴定实验的过程如下:a.取一支碱式滴定管;b.用蒸馏水冲洗;c.加入待测的NaOH溶液;d.记录液面刻度读数;e.用酸式滴定管精确放出一定量标准酸液;f.置于未经标准酸液润洗的洁净锥形瓶中;g.加入适量蒸馏水;h.加入酚酞试液2~3滴;i.滴定时,边滴边摇动;j.注视滴定管内液面的变化;k.当小心滴到溶液由无色变粉红色时,即停止滴定;l.记录液面刻度读数;m.根据滴定管的两次读数得出NaOH溶液体积为22 mL.指出上述实验过程中的错误之处________.
答案:减小,NaOH溶液放在空气中,吸收空气中CO2生成Na2CO3;
(1)Va=Vb,Va<Vb;
(2)酸式滴定管、碱式滴定管、锥形瓶、滴定台(带滴定管夹);
(3)c,j,k,m

滴定过程中反应进行到什么程度,取决于选择的指示剂:
若选用甲基橙为指示剂,其变色范围在pH=3.1~4.4,故滴定反应按①②进行,由关系式:2NaOH→Na2CO3→CO2↑,可知消耗H2SO4的量不变,所以答案为Va=Vb;
若选用酚酞为指示剂,其变色范围在pH=8~10,故滴定反应按①进行,可知消耗H2SO4的量减小,所以答案为Va<Vb.
学生的实际操作,一般原则是标准液放在滴定管中,待测液放在锥形瓶中,但也可反之.滴定管一定要用所盛放的液体润洗.锥形瓶不能润洗,只能用蒸馏水洗,且不需要干燥.装完液体后滴定管都要排气泡,调整液面高度后才能记录液面刻度读数.滴定时,眼睛要观察锥形瓶中溶液颜色的变化,不看滴定管中液面的变化.指示剂变色后要在30秒内颜色不再发生变化,才能确定滴定终点.读数时要精确到0.01 mL.
本题是一道综合性较强的试题,需要有较牢固的基础知识才能答好.关键的知识点有,指示剂的变色范围,酸与碳酸钠反应的过程,中和滴定的仪器,中和滴定的步骤.以上知识点也是该部分的重点和考点,大家要仔细理解,牢固掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
本题有I和II两小题。
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是__________(填写编号)。
(2)能够用以精确量取液体体积的是_______(填写编号)。
(3)由于操作错误,使得到的数据比正确数据偏小的是________(填写编号)。
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(4)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_________g。
(5)有下列实验:
①苯与溴的取代反应 ②苯的硝化反应
③乙醛的银镜反应 ④测定一定温度下KNO3的溶解度
⑤乙酸乙酯的制取 ⑥石油分馏实验
其中需要使用温度计的有___________(填写编号)
Ⅱ.某种胃药片的制酸剂为碳酸钙,其中所含的CaCO3质量的测定如下:
①需配制0.1 mol/L的HCl和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20.00 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去V mL达滴定终点;
④加入25.00 mL 0.1 mol/L的HCl溶液。
(1)写出实验步骤(写编号顺序)___________________________。
(2)在下图所示的仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液肯定不需要的仪器是(填序号)________,配制上述溶液还需要的玻璃仪器是(填仪器名称)_________________________。

(3)配制上述溶液应选用的容量瓶规格是_________(填字母)。
A.50 mL 50 mL B.100 mL 100 mL
C.100 mL 150 mL D.250 mL 250 mL
(4)写出有关的化学方程式______________。
(5)每片胃药中含碳酸钙的质量是____________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
查看答案和解析>>
科目:高中化学 来源:2010年江西省高三9月月考化学试题 题型:实验题
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
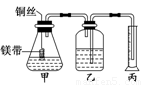
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。

![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com