
 Cr2O72-+H2O
Cr2O72-+H2O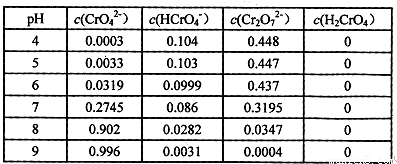


科目:高中化学 来源: 题型:
 Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目:高中化学 来源:烟台模拟 题型:问答题
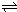
查看答案和解析>>
科目:高中化学 来源: 题型:
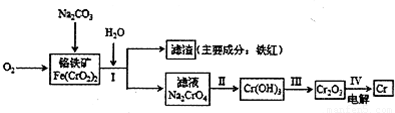
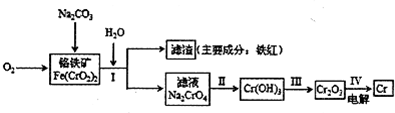
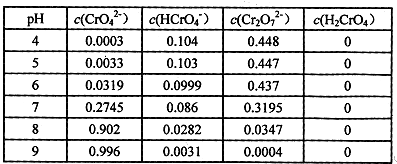
铬抗腐蚀性高,在钢中含量达到12%称为不锈钢。工业上冶炼铬的主要步骤
如下图所示:
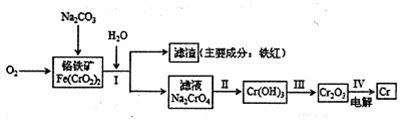
试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O→8Cr(OH)3![]() 十3Na2S2O3十22NaOH
十3Na2S2O3十22NaOH
该反应中氧化剂是 (填化学式),生成 lmolCr(OH)3时转移电子的
物质的量为 mol。
(2)步骤IV中电解Cr2O3的阳极反应式为 ,此时Cr2O3·的状态为 。
(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸。其不溶于浓硝酸的原因
可能是 。
(4)已如:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
①25.C,KSP(Ag2Cr2O4)=1.12![]() 10-12, KSP(Ag2Cr2O7)=2
10-12, KSP(Ag2Cr2O7)=2![]() 10-7,往Na2Cr2O7溶液中加
10-7,往Na2Cr2O7溶液中加
入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 。
②将wg固体Na2CrO4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(![]() )
)
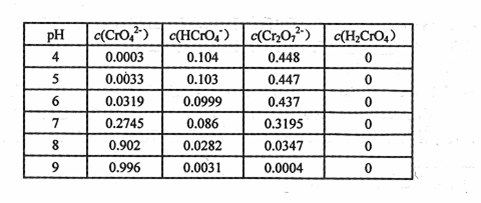 与pH的关系如下表:
与pH的关系如下表:
由上表可知:
Ⅰ.要使溶液中CrO42-的量达到最大,应控制溶液的pH (用>、<、=
及相关数据表示)。
Ⅱ.![]() g固体Na2CrO4的物质的量n= (用数学表达式表示)。
g固体Na2CrO4的物质的量n= (用数学表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com