
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
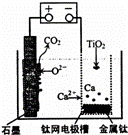
|
| A. | 将熔融CaF2﹣CaO换成Ca(NO3)2溶液也可以达到相同目的 |
|
| B. | 阳极的电极反应式为:C+2O2﹣﹣4e﹣═CO2↑ |
|
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 |
|
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
| 原电池和电解池的工作原理.. | |
| 专题: | 电化学专题. |
| 分析: | 根据图知,阳极上电极反应式为C+2O2﹣﹣4e﹣═CO2↑,阴极上电极反应式为:2Ca2++4e﹣═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2 |
| 解答: | 解:A.将熔融CaF2﹣CaO换成Ca(NO3)2溶液时,阴极上氢离子放电,所以得不到钙,故A错误; B.阳极上电极反应式为C+2O2﹣﹣4e﹣═CO2↑,阴极上电极反应式为2Ca2++4e﹣═2Ca,故B正确; C.阴极上电极反应式为:2Ca2++4e﹣═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2 D.“+”表示原电池正极,所以“+”接线柱应连接原电池正极,故D错误; 故选B. |
| 点评: | 本题考查了电解原理,根据图片知微粒变化确定阴阳极及两个电极上发生的反应,难点是电极反应式的书写,注意该过程中有氧离子参加反应,为易错点. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ;
(2)过程Ⅰ加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程Ⅱ中发生反应的化学方程式为 ;
;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用Na2SO3可以治理工业SO2尾气污染,这是一种治理SO2尾气污染比较新颖的方法。具体操作是: ① 将含有SO2气体的工厂尾气通入到Na2SO3溶液中,使其吸收尾气中的SO2气体;② 将富集有SO2气体的溶液加热,即可使其中的SO2气体逸出,这些SO2气体可以应用于制取H2SO4。该方法中Na2SO3可以循环使用,符合绿色化学的基本原则。请根据上述信息回答下列问题:
(1) 写出①、②两步的化学方程式:
①
;
②
。
(2) 今有10m3的0.1mol·L-1的Na2SO3溶液,每次吸收标准状况下含有SO2气体的尾气89.6m3后,即达到了饱和状态。试求该工厂产生的尾气中SO2气体的体积分数是多少。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
A.氧化性:H2SeO4>Cl2;H2SeO3>H2SO4 B.酸性:H2SO4>H2SeO4> H2SeO3
C.析出l mol硒需要消耗标准状况下22.4 L SO2
D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下:
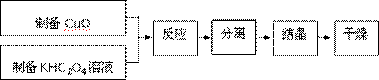
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①过滤所需的玻璃仪器有
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗; b. 。
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作和现象与结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
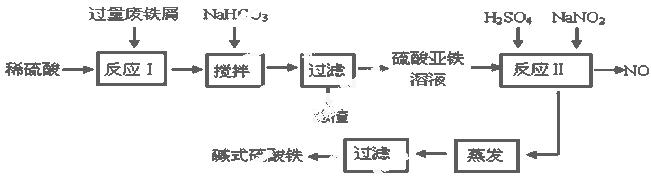
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaNO2+NH4Cl=NaCl+N2↑+2H2O制备N2,下列说法正确的是( )
A.NaNO2发生氧化反应
B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物
D.每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com