
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
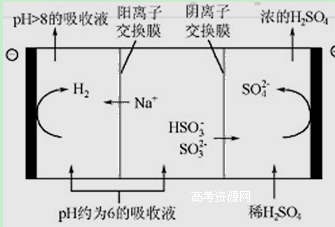
(1)SO32-+ SO2+ H2O =2 HSO3- (2)B C
(3)①酸, 在亚硫酸氢钠溶液中HSO3-存在:HSO3-SO32-+H+和HSO3-+H2OH2SO3+OH-,
HSO3-的电离程度强于水解程度,故溶液呈酸性 ② A
(4)① HSO3-+ H2O= SO42-+H++H2 ↑ ② 1
解析试题分析:(1)用Na2SO3溶液除去SO2的离子方程式为SO32-+ SO2+ H2O =2 HSO3-,(2)由两种酸的电离平衡常数可确定B、C正确。(3)结合表中随n(SO3²﹣):n(HSO3﹣)的比值增大,溶液的pH逐渐减小,确定NaHSO3溶液显酸性,因为HSO3-的电离程度大于水解程度,由电荷守恒可知c(Na+)< 2c(SO32-)+ c(HSO3-),(4)由再生示意图,再生过程中生成H2和SO42-反应的方程式为HSO3-+ H2O= SO42-+H++H2 ↑ 当电极上有1mol电子转移时阴极产物为H2为1g。
考点:弱电解质的电离、离子浓度大小的比较。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4·5H2O。工艺流程如下
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 | Fe(OH)3 | Fe (OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10–38 | 8.0×10–16 | 2.2×10–20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s) mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp= 。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下pH="5" HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式 。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为 。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com