
【题目】下列开发利用自然资源制取化学品,其简示途径较为合理的是( )
A.海水 ![]()
![]() Br2
Br2
B.海产品(如海带等) ![]()
![]() 滤液
滤液 ![]()
![]()
![]() I2
I2
C.海水 ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO ![]() Mg
Mg
D.铝土矿 ![]() 滤液
滤液 ![]() Al(OH)3
Al(OH)3 ![]()
![]() Al
Al
【答案】B
【解析】解:A.海水中不存在溴单质,故A错误;
B.从海带中提取单质碘:先将海带烧成灰,向灰中加水搅拌,再过滤得含碘离子的滤液,取滤液通入足量氯气,然后加入CCl4振荡,最后用分液漏斗分液,故B正确;
C.氧化镁熔点高不易熔融,工业上是利用电解熔融的氯化镁固体得到金属镁,故C错误;
D.铝土矿中的铝元素以氧化铝存在,加入氢氧化钠溶液生成偏铝酸钠溶液,加入氨水不能沉淀铝离子,应通入足量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,故D错误;
故选B.
A.从海水中提取溴:先将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化,然后向酸化的海水中通入足量氯气,使溴离子转化为溴单质,接着将溴单质吹入盛有二氧化硫水溶液中,向吸收塔内通入适量的氯气,用四氯化碳萃取吸收塔中的溴单质;
B.从海带中提取单质碘:先将海带烧成灰,向灰中加水搅拌,再过滤得含碘离子的滤液,取滤液通入足量氯气,然后加入CCl4振荡,最后用分液漏斗分液;
C.从海水中提取镁,最基本的方法是往海水里加碱,得到Mg(OH)2沉淀,将沉淀分离出来后再加入盐酸把它变成MgCl2之后,经过滤、干燥、电解,即可得到金属镁;
D.铝土矿中加入氢氧化钠溶液;氧化铝溶解后得到的是偏铝酸钠,加入氨水不能生成氢氧化铝沉淀;


科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( ) 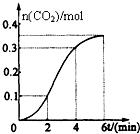
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验. 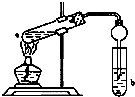
(1)写出a试管中的主要化学反应方程式:;
(2)加入浓硫酸的目的是;
(3)b中观察到的现象是;
(4)在实验中球形干燥管的作用是;
(5)饱和Na2CO3溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取漂白粉的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应的氧化剂与还原剂之比为
A.1:2 B.2:1 C.1:1 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数, X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
(1)写出YX4+的电子式_______。
(2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________。
(3)室温下,pH=3的XW溶液与pH=5的YX4W溶液中由水电离出的c(H+)的比为___。
(4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________。
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
(5)有人设想寻求合适的催化剂和电极材料,以Y2、X2为电极反应物,以XW-YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________。
(6)汽车尾气中含有CO、NO、NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH3=-393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2>T1二者均大于常温)、其他条件相同,下列图像正确的是______。
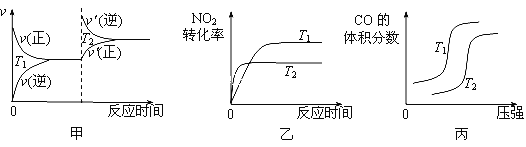
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下: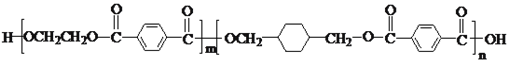 ,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
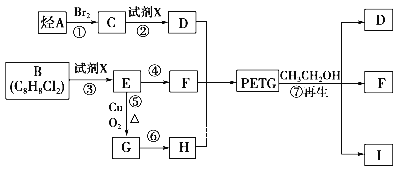
试回答下列问题:
(1)试剂X为______________;反应⑦的反应类型为_______________。
(2)写出物质H的名称________________________。
(3)写出结构简式: I_____________________________。
(4)写出反应⑤的化学方程式:_________________________________________。
(5)合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=__________(用m、n表示)。
(6)同时符合下列要求的物质H的同分异构体共有__________种。
①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应,并有气体放出;③能发生银镜反应。
(7)已知:![]() 请写出由D及其它必要物质可合成
请写出由D及其它必要物质可合成![]() 的反应历程。________________
的反应历程。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的理解正确的是( )
A.原电池一定是负极材料失电子,发生氧化反应
B.电解池的电极材料一定不参与电极反应
C.原电池的负极和电解池的阳极一定发生氧化反应
D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com