
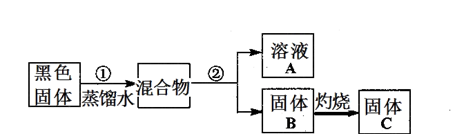
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__ __________________________ | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管,__________ __________________________ | ______________________ | _______________________ |
| 步骤3:往c试管,__________ __________________________ | 先产生_______________, 后____________________ | 说明溶液A含有Zn2+ |
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,滴加适量0.1mol?L-1AgNO3(1分)和2moL?L-1 HNO3 (1分) | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, 加入适量6moL?L-1NaOH(1分)加热(1分),将湿润的红色石蕊试纸置于试管口附近(1分) | 湿润的红色石蕊试纸变蓝色 (1分) | 说明溶液A含有NH4+(1分) |
| 步骤3:往c试管,逐滴加入2moL?L-1NH3·H2O 或 6moL?L-1NaOH(1分)至过量(1分) | 先产生 白色沉淀 (1分),后 白色沉淀溶解 (1分) | 说明溶液A含有Zn2+ |
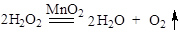 (2分)
(2分)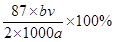 (2分)
(2分) 

科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 ) 
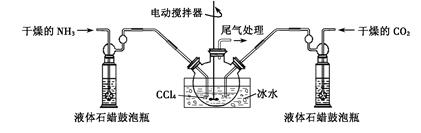
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
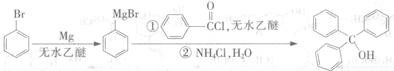
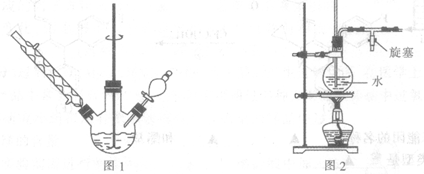
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用盐析法分离NaCl溶液和淀粉胶体 |
| B.除去苯中少量苯酚,向混合物中加人足量的NaOH溶液后过滤 |
| C.加足量的稀盐酸可除去BaCO3固体中少量的BaSO4 |
| D.向硝酸银稀溶液中逐滴加人稀氨水至白色沉淀恰好溶解,即得银氨溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
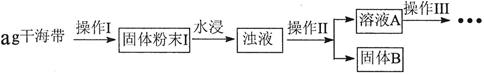
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入______ | 无现象 | 证明不是以IO3ˉ形式存在 |
| ③ | 往试管II中加入_______ | _______________ | 证明以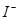 形式存在 形式存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 |  预期现象结论 预期现象结论 |
| 1.取少量样品溶于稀盐酸后,将溶液分成两份 | |
| 2. _______________________________________ | |
| 3. ________________________________________ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
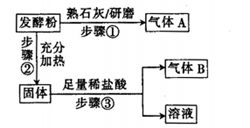
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只用溴水一种试剂既可鉴别甲苯、乙烯、乙醇、四氯化碳、乙醛五种液体 |
| B.苯酚不慎沾到皮肤上,立即用酒精擦洗 |
| C.淀粉溶液中加入淀粉酶,再加入银氨溶液,出现银镜,说明淀粉已经全部水解 |
| D.除去苯甲醇中混有苯甲酸,可以加入过量的生石灰后,再加热蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com