
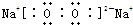 .
.分析 A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子,则A为H元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为C元素;C元素是地壳中含量最多的元素,则C为O元素;D是短周期元素中金属性最强的元素,则D为Na元素;F元素的最高价氧化物的水化物为强酸,则F为Cl元素;E与F的位置相邻,E的原子序数比F(Cl)小,则E为S元素,据此进行解答.
解答 解:A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子,则A为H元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为C元素;C元素是地壳中含量最多的元素,则C为O元素;D是短周期元素中金属性最强的元素,则D为Na元素;F元素的最高价氧化物的水化物为强酸,则F为Cl元素;E与F的位置相邻,E的原子序数比F(Cl)小,则E为S元素,
根据分析可知,A为H、B为C元素、C为O元素、D为Na、E为S、F为Cl,
(1)B为C元素,原子核外有2个电子层,最外层有4个电子,位于周期表第二周期第ⅣA族,
故答案为:二;ⅣA;
(2)F为Cl元素,原子核外有17个电子,其电子排布式为:1s22s22p63s23p5,
故答案为:1s22s22p63s23p5;
(3)C为O元素、D为Na元素,二者形成的淡黄色物质为Na2O2,Na2O2是离子化合物,由钠离子与过氧根离子构成,其电子式为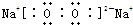 ,
,
故答案为: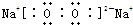 ;
;
(4)A为H元素、C为O元素,氢元素与氧元素形成10电子的微粒有:H2O、H3O+、OH-,
故答案为:H2O;H3O+;OH-.
点评 本题考查位置、结构与性质关系的综合应用,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | NaOH溶液与稀盐酸的反应 | B. | 锌与稀盐酸的反应 | ||
| C. | 氢氧化钡与氯化铵固体的反应 | D. | 一氧化碳在空气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>④>③>① | B. | ①>②>④>③ | C. | ①>②>③>④ | D. | ③>②>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 4 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF比H2O稳定性更强,是由于HF分子间作用力较大 | |
| B. | CC14、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构 | |
| C. | Na投入到水中,有共价键的断裂与形成 | |
| D. | 离子化合物中一定含有离子键,可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | S2-的结构示意图: | ||
| C. | CaO2的电子式: | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com