
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl是盐 |
分析 电离出的阳离子全部是氢离子的纯净物为酸;
电离出的阴离子全部是氢氧根离子的纯净物为碱;
由金属阳离子或铵根离子和酸根离子或非金属离子形成的化合物为盐.
解答 解:A、化合物电离时生成的阳离子有氢离子的不一定是酸,如NaHSO4,故A错误;
B、化合物电离时生成的阴离子有氢氧根离子的不一定是碱,如碱式盐,故B错误;
C、化合物电离时生成金属阳离子或铵根离子和酸根离子的为盐,如:NaCl、NH4Cl,故C正确;
D、由金属阳离子或铵根离子和酸根离子形成的化合物为盐,氯化铵能电离出铵根离子,所以为盐,故D正确;
故选:CD.
点评 本题考查了酸碱盐的判断,根据概念来分析解答即可,注意铵盐都属于盐,解题时往往漏掉“全部”二字而导致错误,为易错点,题目较简单.


科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
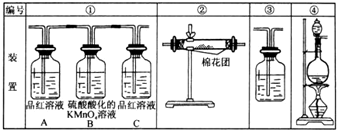 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有气体产生 | B. | 生成白色沉淀 | ||
| C. | 生成无色透明溶液 | D. | 产生气体和白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若硝酸有剩余,溶液中可能含有Fe2+ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况下),则b=0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com