
| A. | ① | B. | ④ | C. | ①②④ | D. | ①②③ |
分析 ①②③为放热反应,物质发生化学反应时,生成液态水比生成气态水放出的热量多,反应越完全,放出的热量越多,
④中前者为吸热反应,后者为放热反应,吸热反应△H>0,放热反应△H<0,以此解答该题.
解答 解:①都为放热反应,△H<0,前者不完全反应,放出的热量少,则△H1>△H2,故①正确;
②都为放热反应,△H<0,由于S(s)→S(g)吸热,则前者放出的热量少,则△H3>△H4,故②正确;
③都为放热反应,△H<0,由于液态水变为气态水吸热,则△H5<△H6,故③错误;
④前者为吸热反应,△H7>0,后者为放热反应,△H8<0,则△H7>△H8,故④正确.
故选C.
点评 本题考查反应热的大小比较,题目难度中等,本题注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,本题中含有能正确判断反应的吸放热.


科目:高中化学 来源: 题型:填空题
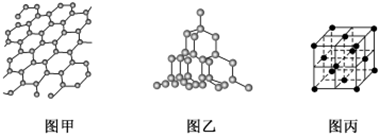
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酸与碱的中和反应 | |
| B. | 镁与盐酸的反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl两种晶体混合搅拌 | |
| D. | 葡萄糖在生物体内氧化生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
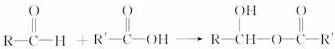
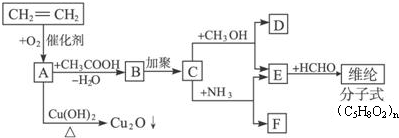
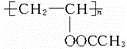 、FCH3CONH2.
、FCH3CONH2.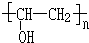 +nHCHO$\stackrel{一定条件}{→}$
+nHCHO$\stackrel{一定条件}{→}$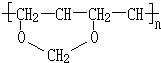 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
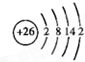 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,5.6 g Fe与足量水蒸气完全反应失去电子数为3×6.02×1022 | |
| B. | FeCl3溶液蒸干、灼烧至恒重,最终剩余固体是FeCl3 | |
| C. | 电解精炼铜时,阳极泥中常含有金属金、银、锌等 | |
| D. | 向0.1 mol•L-1 氨水中加少量水,pH减小,c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸检验牙膏中的摩擦级碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 金属钠与水剧烈反应:Na+2H2O═Na++OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com