
 3s23p1
3s23p1  ;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。
;根据构造原理可知,Al元素的价层电子排布式为 3s23p1。

科目:高中化学 来源:不详 题型:单选题
| A.若Y最高价为+5,则X最高价一定为+6或+7 |
| B.若HnXOm为强酸(m、n均为正整数),则X的氢化物溶液于水一定显酸性 |
| C.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
| D.X的离子半径一定比Y离子半径小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,C ,D 。
,C ,D 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最外层有4个电子的原子都是非金属原子 |
| B.非金属元素形成的单质只能与碱反应,不能与酸反应 |
| C.金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物 |
| D.同主族金属的原子半径越大熔点越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。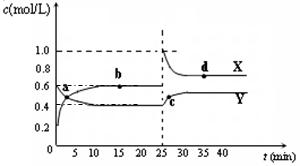
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
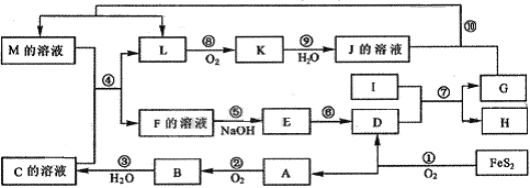
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
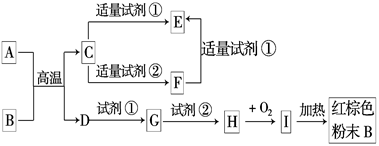
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ①甲+H2O H2↑+乙+丙↑
①甲+H2O H2↑+乙+丙↑  ②H2 + 丙 丁(气体)
②H2 + 丙 丁(气体)  ③乙+丙 甲+戊+H2O
③乙+丙 甲+戊+H2O ④戊+丁 甲+己(酸性),则甲、戊、己依次是
④戊+丁 甲+己(酸性),则甲、戊、己依次是| A.NaCl、NaClO、HClO | B.Na2S、Na2SO3、H2SO3 |
| C.CaCl2、Ca(ClO)2、HClO | D.K2S、K2SO3、H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com