
【题目】下列各组混合物中,能用分液漏斗进行分离的是
A. 水和植物油 B. 水和葡萄糖 C. 水和醋酸 D. 水和酒精
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:
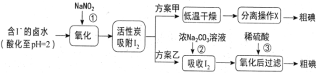
资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是:
A. 此时水的离子积Kw=1×10-14 B. 水电离出的c(H+)=1×10-10molL-1
C. 水的电离程度随温度升高而增大 D. c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个小烧杯里,加入20![]()
![]() 晶体,将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后加入10
晶体,将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后加入10![]()
![]() 晶体,并立即用玻璃棒快速搅拌。
晶体,并立即用玻璃棒快速搅拌。
(1)实验中观察到的现象有:玻璃片与小烧杯粘在一起;烧杯中产生__________的气体;反应混合物成糊状,出现糊状的原因是反应中有__________生成。
(2)写出有关反应的化学方程式__________。
(3)通过__________现象,说明该反应为__________(填“吸热”或“放热”)反应,这是由于反应物的总能量__________(填“小于”或“大于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
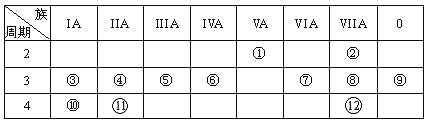
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________,
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:_____。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池装置,回答下列问题:
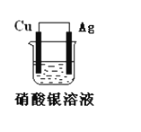
(1)此电池的负极是:______,正极的电极反应式是:________。
(2)该电池工作一段时间后,装置中出现的现象________,将银电极小心取出洗涤并晾干,经称量发现比原来增重了5.4g。则导线中通过的电子的物质的量为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)。___________
Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(5)反应③中氧化产物与还原产物的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水![]() 混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为
混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为![]() 。下列有关说法正确的是
。下列有关说法正确的是
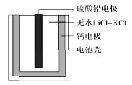
A. 正极反应式:![]()
B. 放电过程中,![]() 向负极移动
向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1mol电子,理论上生成10.35gPb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按酸、混合物、碱顺序排列的是
A. 空气、硫酸铜、硫酸 B. 乙酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰 D. 硝酸、蔗糖水、氢氧化铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com