
| A. | 干燥的 | B. | 以上三项均须要求的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 瓶塞不漏水的 |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液与胶体:不同的本质原因是否发生丁达尔效应 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 氧化还原反应:元素化合价是否变化 | |
| D. | 电解质与非电解质:物质本身的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2CO3>H2SO4 | B. | 金属性:K>Na | ||
| C. | 氧化性:S>Cl2 | D. | 热稳定性:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
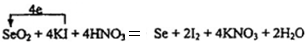 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤ | C. | ③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
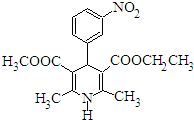 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )| A. | 该物质的分子式为C18H20N2O6 | |
| B. | 该物质可以和银氨溶液发生银镜反应 | |
| C. | 该物质属于芳香族化合物,能溶于水 | |
| D. | 该物质在酸性条件下不发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com