
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
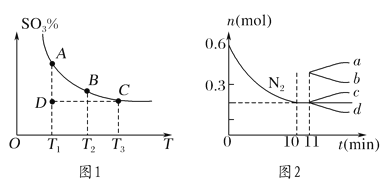
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
【答案】 向左 > D 0.06 mol·L-1·min-1 d
【解析】(1)若在恒温、恒压条件下向上述平衡体系中通入氦气,体积膨胀,相当于减压,平衡向体积减小的方向移动,平衡向左移动。②若反应进行到状态D时,要达到平衡,须向生成SO3的方向进行,v正>v逆;(2))①A、使用的更高效催化剂,反应加快,不影响平衡移动,故A错误;B、升高温度,反应加快,平衡向吸热反应移动,即向逆反应移动,故B错误;C、降低生成物浓度,速率降低,平衡向正反应移动,故C错误;D、充入氮气,增大氮气的浓度,速率加快,平衡向体积减小方向移动,即平衡向正反应移动,故D正确.故选:D;②由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)=![]() =0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin),压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选d。
=0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin),压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选d。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某含铬(Cr2O![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中Cr2O![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子总物质的量为3nxmol
D. 在FeO·FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行实验,甲乙两池均为1 molL—1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓度差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是

A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO3— 向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法中正确的是( )
A.凡是含碳元素的化合物都属于有机物
B.易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物
C.所有的有机物都很容易燃烧
D.大多数有机物的熔沸点比较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对于相关物质的分类全部正确的是
选项 | 纯净物 | 混合物 | 非电解质 | 弱电解质 | 碱性氧化物 |
A. | 液氨 | 氢氧化铁胶体 | CO | 氢硫酸 | Al2O3 |
B. | 明矾 | 漂白粉 | 乙醇 | 硫酸钡 | Na2O |
C. | 碱石灰 | 碘酒 | Cl2 | HClO | K2O |
D. | 磁性氧化铁 | 水玻璃 | SO2 | 冰醋酸 | CaO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
实验 序号 | 温度(℃) | 初始CO浓 度(mol·L-1) | 初始H2O浓 度(mol·L-1) | CO的平衡 转化率 |
1 | 110 | 1 | 1 | 50% |
2 | 100 | 1 | 1 | x |
3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后达到平衡,H2的平均反应速率为________mol·L-1·h-1。在此实验的平衡体系中,再加入0.5molCO和0.5molH2,平衡将________移动(“向左”、“向右”、“不”或“无法确定”)。
(2)实验2中,x的值________(填序号)。
A.等于50% B.大于50%
C.小于50% D.无法确定
(3)实验3中的y值为________。
(4)在100 ℃条件下,能说明该反应达到平衡状态的是________。
A.压强不再变化
B.生成H2O的速率和消耗H2速率相等时
C.混合气体的密度不变
D.H2的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是

A. 分子中所有的原子共面
B. 1mol EGC与4mol NaOH恰好完全反应
C. 易发生氧化反应和取代反应,难发生加成反应
D. 遇FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中关于物质的性质和用途的说法均正确且有因果关系的是
选项 | 性质 | 用途 |
A | 溴化银有感光性 | 用于变色玻璃 |
B | 新制氯水显酸性 | 漂白有色布条 |
C | 浓硫酸有强氧化性 | 干燥剂 |
D | 氨气是碱性气体 | 液氨作制冷剂 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com