
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
 .
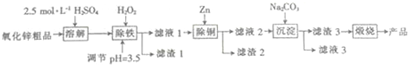
. 分析 制备活性氧化锌流程为:氧化锌粗品(含有FeO、Fe2O3、CuO杂质)中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,溶液中含有铁离子、亚铁离子、锌离子、铜离子,向溶液中加入双氧水将亚铁离子氧化得铁离子,调节PH值使铁离子生成氢氧化铁;过滤,滤渣1为氢氧化铁,滤液1中含有锌离子、铜离子,加入过量锌粉,铜离子被置换成铜单质,通过过滤得到的滤液2中含有锌离子,滤渣2中含有铜单质和过量的锌粉;向滤液2中加入适量碳酸钠溶液得到沉淀ZnCO3•2Zn(OH)2•H2O,经过煅烧得到ZnO,据此答题.
解答 解:制备活性氧化锌流程为:氧化锌粗品(含有FeO、Fe2O3、CuO杂质)中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,溶液中含有铁离子、亚铁离子、锌离子、铜离子,向溶液中加入双氧水将亚铁离子氧化得铁离子,调节PH值使铁离子生成氢氧化铁;过滤,滤渣1为氢氧化铁,滤液1中含有锌离子、铜离子,加入过量锌粉,铜离子被置换成铜单质,通过过滤得到的滤液2中含有锌离子,滤渣2中含有铜单质和过量的锌粉;向滤液2中加入适量碳酸钠溶液得到沉淀ZnCO3•2Zn(OH)2•H2O,经过煅烧得到ZnO,
(1)检验产品中是否含有Na+可以通过焰色反应进行,具体操作是将铂丝蘸盐酸在无色火焰上灼烧到无色,再蘸取少量产品在无色火焰上灼烧,观察火焰颜色,若呈黄色,则证明有Na+,反之,则证明没有Na+,
故答案为:焰色反应;将铂丝蘸盐酸在无色火焰上灼烧到无色,再蘸取少量产品在无色火焰上灼烧,观察火焰颜色,若呈黄色,则证明有Na+,反之,则证明没有Na+;
(2)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(CO32-)>c(OH-)>c (HCO3-),
故答案为:c(CO32-)>c(OH-)>c (HCO3-);
(3)根据上面的分析可知,滤渣1为氢氧化铁,化学式是Fe(OH)3,双氧水具有强氧化性,在酸性条件下,双氧水将Fe2+氧化为Fe3+,自身被还原为H2O,反应离子方程式为2Fe2++H2O2+2H +=2Fe3++2H2O.
故答案为:Fe(OH)3;2Fe2++H2O2+2H +=2Fe3++2H2O;
(4)“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑,
故答案为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑;
(5)氯乙烯在纳米活性氧化锌作用下发生加聚反应可生成聚氯乙烯,方程式为:nCH2=CHCl$\stackrel{纳米活性氧化锌}{→}$ ,
,
故答案为:nCH2=CHCl$\stackrel{纳米活性氧化锌}{→}$ .
.
点评 本题考查了物质制备方案的设计、物质分离与提纯方法的综合应用,题目难度较大,明确制备流程为解答关键,注意掌握常见物质分离与提纯的操作方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐和油都是生活必需品.加碘盐中的碘以碘化钾的形式存在;而植物油变质是由于发生了酯化反应 | |
| B. | “神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中四氧化二氮作氧化剂 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 近期正热播柴静的雾霾调查纪录片《穹顶之下》.PM2.5是灰霾天气的主要原因,是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CO(g)+NO2(g)?CO2(g)+NO(g),△H<0,达到平衡后,升高温度系颜色变深 | |
| B. | 高压比常压有利于SO2与O2合成SO3的反应. | |
| C. | 加入催化剂有利于N2与H2合成NH3的反应 | |
| D. | 工业制取金属钾[Na(l)]+KCl(l)?NaCl(l)+K(g)]选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 氧化铜和稀硫酸反应:CuO+2H+═Cu2++H2O | |
| C. | 碳酸氢钠溶液和稀硫酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向待测溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 向待测溶液中逐滴加入氢氧化钠溶液,开始有白色沉淀生成,继续滴加氢氧化钠溶液到过量,沉淀逐渐溶解,一定有Al3+ | |
| C. | 向待测溶液中先滴加盐酸酸化未出现沉淀,再加入BaCl2 溶液有白色沉淀产生,一定有SO42- | |
| D. | 向待测溶液中滴加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | Na2CO3溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═2NH4++Mg(OH)2↓ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-++ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com