
| A. | 整个过程中的还原剂只有I2 | |
| B. | CCl4层由紫色变成无色的化学反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl | |
| C. | 若用KI和Cl2反应制1molKIO3,至少需要56LCl2(标准状况) | |
| D. | 把 KI换成NBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HBrO3<Cl2<HIO3 |
分析 氯水与KI反应生成碘,CCl4层萃取碘单质变成紫色,继续滴加氯水,氯气将碘单质氧化为碘酸根离子,以此来解答.
解答 解:A.氯水与KI反应生成碘,CCl4层萃取碘单质变成紫色,继续滴加氯水,氯气将碘单质氧化为碘酸根离子,所以整个过程中的还原剂有碘离子和碘单质,故A错误;
B.氯气将碘单质氧化为碘酸根离子,所以由紫色变成无色,反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl,故B正确;
C.若用KI和Cl2反应制1molKIO3,则根据得失电子守恒,至少需要Cl2体积为$\frac{5-(-1)}{2}$×22.4=67.2L,故C错误;
D.把 KI换成KBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,说明氯气不能将溴单质氧化为溴酸根离子,所以Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HIO3<Cl2<HBrO3,故D错误;
故选B.
点评 本题考查氯气的性质,侧重氧化还原反应的考查,注意现象与反应的对应关系,明确发生额反应即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
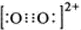 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③② | C. | ③②① | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
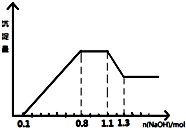 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ | |
| B. | 溶液中一定不含CO32-和NO3-,一定含有SO42- | |
| C. | 溶液中c(NH4+)=0.3 mol/L | |
| D. | c(H+):c(Al3+):c(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | SO2水溶液能导电,所以 SO2是电解质 | |
| C. | 胶体是纯净物,可以用丁达尔效应鉴别胶体和溶液 | |
| D. | 人们在认识事物时往往需要采用多种分类方法,来弥补单一分类方法的不足 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量时,反应为放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,即△H>0,反应吸热 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的浓度为0.4 mol•L-1 | B. | X2、Z的浓度均为0.15 mol•L-1 | ||
| C. | X2与Z的浓度之和为0.4 mol•L-1 | D. | X2的浓度为0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com