
分析 (1)用托盘天平称取5.2g无水BaCl2晶体时,应先调零,根据要称量的药品的质量为5.2g来选择5g的砝码和0.2g游码,应注意药品应放在纸上称量,据此分析;
(2)称量固体药品时,如果要添加少量的药品,应轻拍手腕,使少量晶体落入烧杯中;
(3)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析操作步骤和需要的仪器;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)天平的正确使用步骤:a把天平放到水平台上,游码移到标尺左端的零刻度.
b调节天平的平衡螺母使指针指到分度盘的中央,或左右偏转的格数相同.
c物体放在天平的左盘,砝码放在天平的右盘,并调节游码在标尺上的位置,直至横梁恢复平衡.要用镊子夹取砝码,要轻拿轻放,要从大到小.
d物体的质量=砝码的质量+游码对应的刻度.
e整理器材,所以正确的顺序为:BCFAEDB;
故答案为:C;F;D;B;
(2)称量固体药品时,添加药品只缺少量晶体时,应轻拍手腕,使少量晶体落入烧杯中;
故答案为:轻拍手腕,使少量晶体落入烧杯中;
(3)配制一定物质的量浓度溶液的操作步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,溶解时,固体应放在烧杯中,用玻璃棒不断搅拌;
故答案为:烧杯;250mL容量瓶;洗涤;定容;摇匀;
(4)A.将砝码放在左盘上,BaCl2放在右盘上进行称量,导致称取的质量偏小,溶质的物质的量偏小,溶液的浓度偏低,故A选;
B.选用的容量瓶内有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不受影响,故B不选;
C.定容摇匀后,液面下降,又加水至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故C选;
D.整个配制过程中,容量瓶不振荡,会导致溶液混合不均匀,溶液的体积可能偏大或偏小,溶液的浓度可能偏低或偏高,故D不选;
故选:AC.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ②③④① | C. | ②③①④ | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3﹒10H2O晶体 | |
| B. | 本实验需用到的仪器是天平、药匙、玻璃棒、烧杯、100mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
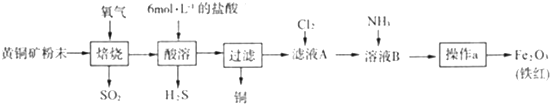
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
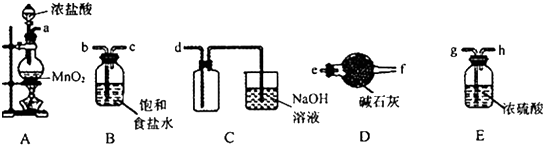
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
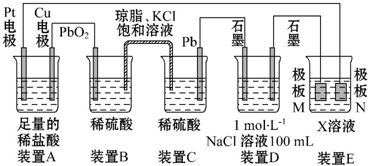
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com