
| A. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 | |
| B. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤的方法除去 | |
| C. | 家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| D. | 可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
分析 A.防治龋齿的有效成分是氟离子,当氟离子浓度相等时,防治龋齿的作用相同;
B.塑化剂为致癌性物质,且易溶于乙醇;
C.“84”消毒液与洁厕灵混合发生氧化还原反应生成有毒气体氯气;
D.浓盐酸与氨气接触冒白烟.
解答 解:A.防治龋齿的有效成分是氟离子,则在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的,故A正确;
B.塑化剂为致癌性物质,且易溶于乙醇,则不能饮用含塑化剂的白酒,且不能过滤除去塑化剂,故B错误;
C.“84”消毒液与洁厕灵混合发生氧化还原反应生成有毒气体氯气,则家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故,故C正确;
D.浓盐酸与氨气接触冒白烟,则可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应和性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
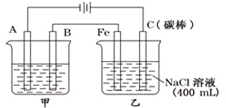 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
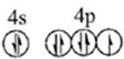 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
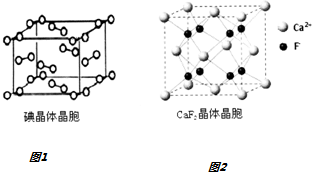
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
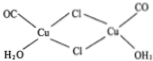 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com