
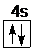 ,钙原子核外电子排布式为:1s22s22p63s23p64s2,不同能级中电子能量不同,相同能级的电子能量相同,故有6种能量不同的电子,故答案为:
,钙原子核外电子排布式为:1s22s22p63s23p64s2,不同能级中电子能量不同,相同能级的电子能量相同,故有6种能量不同的电子,故答案为: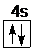 ;6;
;6;

 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2013-2014学年浙江省六校(省一级重点校)高三3月联考化学试卷(解析版) 题型:选择题
香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是:
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D.XR2、WR2两化合物中R的化合价相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com