
分析 在水溶液里或熔融状态下能够导电的化合物属于电解质,电解质分为强电解质和弱电解质,在水溶液中部分电离的电解质为弱电解质,在水溶液中完全电离的电解质为强电解质,弱电解质主要包括弱酸、弱碱、水等,据此进行判断.
解答 解:CH3COOH是弱酸,属于弱电解质;NaOH是强碱,属于强电解质;NH3•H2O是弱碱,属于弱电解质;CH3COONa是盐,属于强电解质;NaCl是盐,属于强电解质;由分析可知,属于弱电解质的是:CH3COOH、NH3•H2O.
故答案为:CH3COOH、NH3•H2O.
点评 本题考查弱电解质的概念及判断,难度不大,注意“电解质是化合物,单质和混合物不是电解质,强电解质完全电离,弱电解质部分电离”.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该有机物中一定含有氧元素 | |
| B. | 该有机物分子中碳氢原子数之比为1:3 | |
| C. | 该有机物中一定不含有氧元素 | |
| D. | 该有机物分子式为C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3体积/mL | 26.90 | 26.55 | 27.00 | 26.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
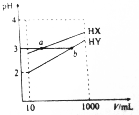 常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )
常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )| A. | HX的电离常数K(HX)大于HY的电离常数K(HY) | |
| B. | a点水的电离程度大于b点水的电离程度 | |
| C. | a、b两点对应的两种酸等体积混合后溶液的pH大于混合前溶液的pH | |
| D. | 浓度均为0.1mol/L的NaX和NaY组成的混合溶液中c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
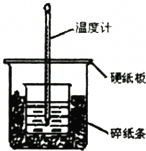 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com